Calor específico (sensível) e trocas de calor sem mudança de estado
Exercícios de vestibulares com resolução comentada sobre
Calor específico (sensível) e trocas de calor sem mudança de estado
01-(FAPA) Super manual de sobrevivência
Fogo é fundamental:
Óculos de (grau ou escuros) servem para acender fogueiras, importantíssimas para a noite, quando a temperatura cai dramaticamente.
Durante o dia, a temperatura no deserto é muito elevada e, durante a noite, sofre uma grande redução.
Isto pode ser explicado pelo _____________da areia.
a) pequeno calor específico
b) grande calor específico
c) pequeno ponto de fusão
d) grande ponto de fusão
e) pequeno calor latente de fusão.
02-(PUC-RS) Um médico recomendou a um paciente que fizesse exercícios com uma toalha quente sobre os ombros, a qual poderá ser aquecida, a uma mesma temperatura, embebedando-a com água quente ou utilizando-se um ferro de passar roupa, que a manterá seca. Quando a temperatura da toalha tiver baixado 10oC, a toalha:
a) úmida terá liberado mais calor que a seca, devido ao grande calor específico da água.
b) úmida terá liberado menos calor que a seca, devido ao pequeno calor específico da água.
c) seca terá liberado a mesma quantidade de calor que a toalha úmida.
d) seca terá liberado mais calor que a úmida, devido à grande massa específica da água.
e) seca terá liberado menos calor que a úmida, devido à pequena massa específica da água.
03-(ENEM-MEC) A eficiência do fogão de cozinha pode ser analisada em relação ao tipo de energia que ele utiliza. O gráfico a seguir mostra a eficiência de diferentes tipos de fogão.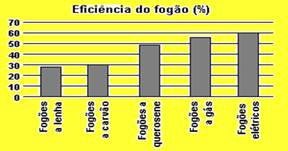
Pode-se verificar que a eficiência dos fogões aumenta
a) à medida que diminui o custo dos combustíveis.
b) à medida que passam a empregar combustíveis renováveis.
c) cerca de duas vezes, quando se substitui fogão a lenha por fogão a gás.
d) cerca de duas vezes, quando se substitui fogão a gás por fogão elétrico.
e) quando são utilizados combustíveis sólidos.
04-(PUC-MG) O calor específico da água é 1 cal/g.°C (uma caloria por grama grau Celsius). Isso significa que:
a) para se aumentar a temperatura em um grau Celsius de um grama de água, deve-se fornecer um caloria.
b) para se diminuir a temperatura em um grau Celsius de um grama de água, deve-se fornecer um caloria.
c) para se diminuir a temperatura em um grau Celsius de um grama de água, devem-se retirar 10 calorias.
d) para se aumentar a temperatura em um grau Celsius de um grama de água, deve-se retirar um caloria.
05-(UNESP-SP) Massas iguais de cinco líquidos distintos, cujos calores específicos estão dados na tabela adiante, encontram-se armazenadas, separadamente e à mesma temperatura, dentro de cinco recipientes com boa isolação e capacidade térmica desprezível.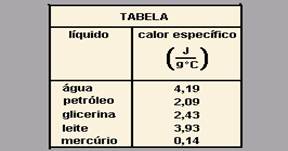
Se cada líquido receber a mesma quantidade de calor, suficiente apenas para aquecê-lo, mas sem alcançar seu ponto de ebulição, aquele que apresentará temperatura mais alta, após o aquecimento, será:
a) a água.
b) o petróleo.
c) a glicerina.
d) o leite.
e) o mercúrio.
06-(PUCCAMP-SP) Admita que o corpo humano transfira calor para o meio ambiente na razão de 2,0 kcal/min. Se esse calor pudesse ser aproveitado para aquecer água de 20 °C até 100 °C, a quantidade de calor transferida em 1 hora aqueceria uma quantidade de água, em kg, igual a:
Dado: calor específico da água = 1,0 kcal/kg °C
a) 1,2.
b) 1,5.
c) 1,8.
d) 2,0.
e) 2,5.
07-(CPS-SP) Muitos estudos têm demonstrado a necessidade de uma dieta alimentar balanceada para diminuir a incidência de doenças e aumentar a qualidade e o tempo de vida do homem.
Durante o intervalo, um estudante consumiu um lanche feito de pão e hambúrguer, 50 g de batata frita, 1 caixinha de água de coco e 50 g de sorvete.
Considere a tabela a seguir.
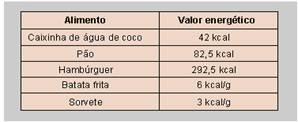
O valor energético total, obtido pela ingestão do lanche é, aproximadamente, em kcal, de
![]()
08-(MACKENZIE-SP) Uma fonte térmica fornece 55 cal/s com potência constante. Um corpo de massa 100 g absorve totalmente a energia proveniente da fonte e tem temperatura variando em função do tempo, conforme o gráfico abaixo.
A capacidade térmica desse corpo e o calor específico da substância de que é constituído são, respectivamente, iguais a: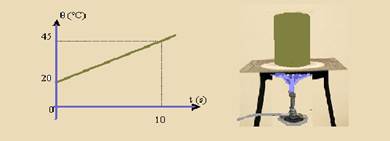
a) 2,2 cal/°C e 0,022 cal/g °C.
b) 2,2 cal/°C e 0,22 cal /g °C.
c) 2,2 cal/°C e 2,2 cal/g °C.
d) 22 cal /°C e 0,22 cal/g °C.
e) 22 cal/°C e 0,022 cal/g °C.
09-(PUC-MG) Dois corpos X e Y recebem a mesma quantidade de calor a cada minuto. Em 5 minutos, a temperatura do corpo X aumenta 30°C, e a temperatura do corpo Y aumenta 60°C.
Considerando-se que não houve mudança de fase, é correto afirmar:
a) A massa de Y é o dobro da massa de X.
b) A capacidade térmica de X é o dobro da capacidade térmica de Y.
c) O calor específico de X é o dobro do calor específico de Y.
d) A massa de Y é a metade da massa de X.
10-(UFSCAR-SP) A quantidade de calor que se deve fornecer a 1kg de uma substância para elevar sua temperatura de 5oC é igual a 3,000cal. Qual o calor específico da substância no intervalo de temperatura considerado?
11-(UNICAMP-SP) As temperaturas nas grandes cidades são mais altas do que nas regiões vizinhas não povoadas, formando “ilhas urbanas de calor”. Uma das causas desse efeito é o calor absorvido pelas superfícies escuras, como as ruas asfaltadas e as coberturas de prédios. A substituição de materiais escuros por materiais alternativos claros reduziria esse efeito. A figura mostra a temperatura do pavimento de dois estacionamentos, um recoberto com asfalto e o outro com um material alternativo, ao longo de

um dia ensolarado.
a) Qual curva corresponde ao asfalto?
b) Qual é a diferença máxima de temperatura entre os dois pavimentos durante o período apresentado?
c) O asfalto aumenta de temperatura entre 8h00 e 13h00. Em um pavimento asfaltado de 10.000 m2 e com uma espessura de 0,1 m, qual a quantidade de calor necessária para aquecer o asfalto nesse período? Despreze as perdas de calor. A densidade do asfalto é 2.300 kg/m3 e seu calor específico c = 0,75kJ/kg°C.
12-(UERJ-RJ) Observe o diagrama adiante, que mostra a quantidade de calor Q fornecida a um corpo.
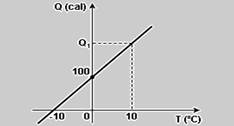
O valor de Q1 indicado no diagrama, em calorias, é:
![]()
(FUVEST-SP) O esquema refere às questões 13 e 14.
Para aquecer 500g de água e 500g de óleo, utilizam-se dois recipientes iguais e de massa desprezível colocados simultaneamente (em t=0) sobre bicos de Bunsen iguais. As temperaturas são medidas para os dois líquidos , obtendo o gráfico abaixo (calor específico da água igual a 1,0 cal/goC).
13- (FUVEST-SP)
a) Quais as temperaturas da água e do óleo no instante t=1,5 minutos?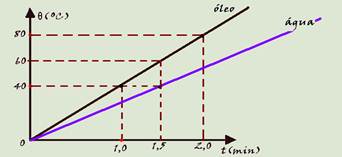
b) Qual dos líquidos tem maior calor específico? Justifique.
14- (FUVEST-SP)
a) Qual a razão entre os calores específicos da água e do óleo?
b) Qual o calor específico do óleo?
15-(UFRRJ-RJ) Um estudante utiliza um circuito elétrico, composto por uma bateria de 12 V e um resistor de 100 Ώ, para aquecer uma certa quantidade de água, inicialmente a 20 °C, contida em um recipiente.
O gráfico a seguir representa a temperatura da água, medida por um termômetro trazido pelo estudante, em função do tempo.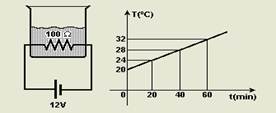
Dados o calor específico da água c = 4,2 J/g °C e densidade da água μ = 1,0 g/cm3, determine
a) a quantidade de calor recebida pela água ao final de uma hora;
b) o volume de água contido no recipiente.
16-(UFPR-PR) O gráfico mostrado na figura a seguir apresenta as quantidades de calor absorvidas por dois corpos A e B, cujas massas estão relacionadas por mB=30mA, num intervalo em quea temperatura varia de 0oC a 40oC.
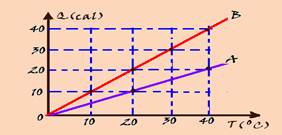
Com base nesses dados, calcule a razão cA/cB dos calores específicos das substâncias que compõem os corpos A e B, explicando como você obteve essa solução.
17-(MACKENZIE-SP) Na atividade de laboratório, Fábio aquece um corpo com o objetivo de determinar sua capacidade térmica. Para tanto, utiliza uma fonte térmica, de potência constante, que fornece 60 calorias por segundo e constrói o gráfico abaixo.
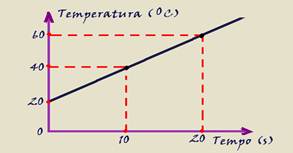
Calcule a capacidade térmica do corpo.
18-(UNESP-SP) A figura mostra as quantidades de calor Q absorvidas, respectivamente, por dois corpos, A e B, em função de suas temperaturas.
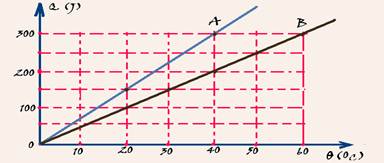
a) Determine a capacidade térmica CA do corpo A e a capacidade térmica CB do corpo B, em J/oC.
b) Sabendo que o calor específico da substância de que é feito o corpo B é duas vezes maior que o da substância de A, determine a razão mA/mB entre as massas de A e B.
19-(PUC-SP) Um forno de microondas produz ondas eletromagnéticas que aquecem os alimentos colocados no seu interior ao provocar a agitação e o atrito entre as moléculas.
Se colocarmos no interior do forno um copo com 250 g de água a 20ºC, quanto tempo será necessário para aquecê-la a 100ºC? Suponha que as microondas produzem 10.000 cal/min na água e despreze a capacidade térmica do copo. (Dado: calor específico da água = 1,0 cal/gºC).
Calcule a Quantidade de Calor necessária para aquecer essa quantidade de água a 20ºC até 100ºC:
20-(UERJ-RJ) Um adulto, ao respirar durante um minuto, inspira, em média, 8,0 litros de ar a 20 °C, expelindo-os a 37 °C.

Admita que o calor específico e a densidade do ar sejam, respectivamente, iguais a 0,24 cal . g-1. °C¢ e 1,2 g . L-1.
Nessas condições, a energia mínima, em quilocalorias, gasta pelo organismo apenas no aquecimento do ar, durante 24 horas, é aproximadamente igual a:
![]()
21-(PUC-SP) Ana, em sua casa de praia, deseja ferver 2 litros de água numa chaleira de alumínio de 500 g, ambos na temperatura ambiente de 25°C. No entanto, seu botijão de gás natural possui apenas 1% da sua capacidade total.
Considerando a perda de calor para o meio ambiente de 35%, a quantidade de gás disponível é:
– Considere: Densidade da água = 1 g/cm3
Calor específico da água = 1,0 cal/g°C
– Calor específico do alumínio = 0,2 cal/g°C
Capacidade total do botijão = 13 kg ou 31 litros
– Calor de combustão do gás natural = 12.000 kcal/kg
a) Suficiente, afinal ela necessita de aproximadamente 10 gramas.
b) Suficiente, afinal ela necessita de aproximadamente 20 gramas.
c) Suficiente, afinal ela necessita de aproximadamente 30 gramas.
d) Insuficiente, já que ela precisa de 200 gramas.
e) Insuficiente, já que ela precisa de 300 gramas.
22-(UFSC-SC) Em um dia calmo de verão, Paula encontra-se em uma praia sob forte incidência de raios solares. Lembrando-se de que o calor específico da água é bem maior do que o da terra, ela observou atentamente alguns fenômenos, buscando relacioná-los com as explicações e comentários apresentados pelo seu professor de Física (Chico Boca) para os mesmos.
Considerando a situação descrita, assinale a(s) proposição(ões) CORRETA(S).
01. Durante o dia, a temperatura da terra é maior do que a da água porque o calor específico da terra é menor do que o da água.
02. Durante a noite, a temperatura da água é menor do que a da terra porque o calor específico da água é maior do que o da terra.
04. Durante o dia, percebia-se na praia uma brisa soprando da terra para o mar. Uma possível justificativa é porque a massa de ar junto à terra estava mais aquecida do que a massa de ar junto ao mar.
08. Durante a noite, percebia-se na praia uma brisa soprando do mar para a terra. Uma possível justificativa é porque a massa de ar junto ao mar estava mais aquecida do que a massa de ar junto à terra.
16. Após o pôr-do-sol, a água se resfriou mais rapidamente do que a terra, porque o calor específico da água é maior do que o da terra.
32. Após o pôr-do-sol, a terra se resfriou mais rapidamente do que a água do mar, porque o calor específico da água é bem maior do que o da terra.
64. Foi possível observar que a água e a terra apresentaram a mesma temperatura, sempre.
23-(UFMS-MS) No interior de um forno de microondas encontra-se um prato que contém 1 kg de purê de batatas para ser aquecido.

Considere que o purê de batatas possui calor específico c = 1,8 cal/g° C, e que a capacidade térmica C do prato é de 20 cal/° C. A potência elétrica de consumo do forno é igual a 1.200W, dos quais 80% dessa potência são transferidos como energia térmica para o purê de batatas, o qual por condução aquece o prato, considere que somente essa energia é transferida para o prato. Antes de ligar o forno de micro-ondas, todo esse sistema está em equilíbrio térmico na temperatura de 20° C. Assinale a alternativa que corresponde ao tempo em que o forno de microondas deve ficar ligado para que o prato e o purê de batatas atinjam a temperatura de 50° C. Use a relação que 1 cal = 4,18 J.
a) Igual a 3,6 minutos.
b) Igual a 3,2 minutos.
c) Mais que 3,7 minutos.
d) Igual a 3,0 minutos.
e) Menos que 2,0 minutos.
24-(PUC-MG) O ebulidor, dispositivo usado nas residências para o aquecimento da água, é um exemplo bem ilustrativo de aplicação do efeito JOULE. Esse fenômeno foi estudado no século XIX pelo cientista James P. Joule e consiste na transformação da energia
elétrica perdida pelas cargas da corrente elétrica em calor.
Considere um ebulidor ligado a uma tensão de 120V imerso em um recipiente que contenha um litro de água a 20°C. Admitindo-se que todo o calor originado da resistência elétrica seja transferido à água, o valor da resistência do ebulidor para que a água atinja a temperatura de 100°C em 2,0 minutos será de, aproximadamente:
Considere: c = 4,18 J/g°C e ρ = 1kg/Litro
![]()
25-(INATEL-MG) Calor de combustão é a quantidade de calor liberada na queima de uma unidade de massa do combustível.
O calor de combustão do gás de cozinha é 6,0.106 cal/kg. Calcule o volume de água, em litros, que pode ser aquecido de 20 °C a 100 °C com um botijão de gás de cozinha de 13 kg, admitindo que esse processo tenha uma eficiência de 40%.
Dados: calor especifico da água c = 1 cal/g °C; densidade da água d = 1,0·103 g/L
26-(UNESP-SP) Em um dia ensolarado, a potência média de um coletor solar para aquecimento de água é de 3kW. Considerando a taxa de aquecimento constante e o calor específico da água igual a 4.200 J/(kg.oC), o tempo gasto para aquecer 30 kg de água de 25oC para 60oC será, em minutos de
a) 12,5
b) 15
c) 18
d) 24,5
e) 26
27-(UF-ES) Misturando-se um litro de água a 70 °C e dois litros de água a 10°C, obtemos três litros de água a:

![]()
28-(FUVEST-SP) Misturam-se 200 g de água a 0 °C com 250 g de um determinado líquido a 40 °C,

obtendo-se o equilíbrio a 20°C.Qual o calor específico do líquido? Dado: calor específico da água = 1 cal/g°C. Desprezam-se as trocas de calor com outros sistemas.
29-(MACKENZIE-SP) Um calorímetro de capacidade térmica 40 cal/oC contém 110g de água (calor específico=1cal/goC) a 90oC. Que massa de alumínio (calor específico=0,2cal/goC) a 20oC, devemos colocar nesse calorímetro para esfriar a água a 80oC?
30-(UFRJ-RJ) Uma substância x tem massa igual a 1.000 g e se encontra a uma temperatura de 100oC. Ela é misturada com 300 g de água que se encontra a 20oC. A temperatura de equilíbrio da mistura é 40oC. Calcule o calor específico da substância x.
31-(UFG-GO) Um biólogo, querendo verificar se estava correta a temperatura indicada por sua estufa, fez a seguinte experiência:
1. Colocou um objeto metálico na estufa. Após o equilíbrio térmico, colocou o objeto em uma garrafa térmica (calorímetro de capacidade térmica desprezível) contendo 100g de água a 20oC. Mediu a temperatura de equilíbrio térmico entre o objeto e a água e encontrou 31oC.
2. Colocou novamente na estufa dois objetos metálicos idênticos ao anterior. Após o equilíbrio térmico, colocou-os na garrafa térmica, contendo, novamente, 100g de água a 20oC. Mediu a nova temperatura de equilíbrio térmico entre os dois objetos e a água e encontrou 40oC.
Admitindo que o indicador de temperatura da estufa estivesse funcionando corretamente, qual deveria ser a temperatura indicada na estufa?
32-(UNESP-SP) Uma zelosa “mãe de primeira viagem” precisa preparar o banho do recém-nascido, mas não tem termômetro. Seu pediatra disse que a temperatura ideal para o banho é de 38 °C. Ela mora a beira-mar e acabou de ouvir, pelo rádio, que a
a temperatura ambiente é de 32 °C. Como boa estudante de Física, resolve misturar água fervente com água à temperatura ambiente, para obter a temperatura desejada.
a) Enuncie o princípio físico em que se baseia o seu procedimento.
b) Suponha que ela dispõe de uma banheira com 10 litros de água à temperatura ambiente. Calcule qual é, aproximadamente, o volume de água fervente que ela deve misturar à água da banheira para obter a temperatura ideal. Admita desprezível o valor absorvido pela banheira e que a água não transborde.
33-(UFRJ-RJ) Para a refrigeração do motor de um automóvel, tanto se pode usar o ar como a água. A razão entre a massa de ar e a massa de água para proporcionar a mesma refrigeração no motor do automóvel deverá ser igual a:
Dados:
c (ar) = 0,25 cal/g°C e c (água) = 1,0 cal/g°C
a) 0,25
b) 1,0
c) 1,2
d) 2,5
e) 4,0
34-(UFSCAR-SP) Após ter estudado calorimetria, um aluno decide construir um calorímetro usando uma lata de refrigerante e isopor. Da latinha de alumínio removeu parte da tampa superior. Em seguida, recortou anéis de isopor, de forma que estes se encaixassem na latinha recortada, envolvendo-a perfeitamente (Figura 1).
Em seu livro didático, encontrou as seguintes informações (Figura 2):
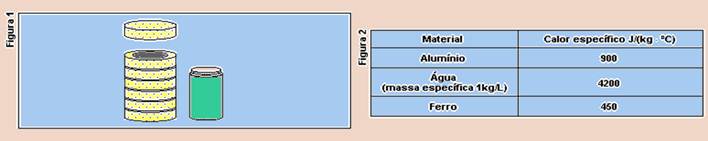
a) Determine a capacidade térmica desse calorímetro, sabendo que a massa da latinha após o recorte realizado era de 15 . 10¤ kg.
b) Como a capacidade térmica do calorímetro era muito pequena, decidiu ignorar esse valor e então realizou uma previsão experimental para o seguinte problema:
Determinar a temperatura que deve ter atingido um parafuso de ferro de 0,1 kg aquecido na chama de um fogão.
Dentro do calorímetro, despejou 0,2 L de água. Após alguns minutos, constatou que a temperatura da água era de 19 °C. Aqueceu então o parafuso, colocando-o em seguida no interior do calorímetro. Atingido o equilíbrio térmico, mediu a temperatura do interior do calorímetro, obtendo 40 °C. Nessas condições, supondo que houvesse troca de calor apenas entre a água e o parafuso, determine aproximadamente a temperatura que este deve ter atingido sob o calor da chama do fogão.
35-(UNICAMP-SP) Um rapaz deseja tomar banho de banheira com água à temperatura de 30°C, misturando água quente e fria.
Inicialmente, ele coloca na banheira 100 litros de água fria a 20°C. Desprezando a capacidade térmica da banheira e a perda de calor da água, pergunta-se:
a) quantos litros de água quente, a 50°C, ele deve colocar na banheira?
b) se a vazão da torneira de água quente é de 0,20 litros/s, durante quanto tempo a torneira deverá ficar aberta?
36-(UNESP-SP) Após assistir a uma aula sobre calorimetria, uma aluna conclui que, para emagrecer sem fazer muito esforço, bastaria tomar água gelada, já que isso obrigaria seu corpo a ceder calor

para a água até que esta atingisse a temperatura de 36,5°C. Depois, esta água seria eliminada levando consigo toda essa energia e sem fornecer nenhuma energia para o corpo, já que água “não tem caloria”. Considerando que ela beba, num dia, 8 copos de 250 mL de água, a uma temperatura de 6,5°C, a quantidade de calor total que o corpo cederá à água para elevar a sua temperatura até 36,5°C equivale, aproximadamente, a energia fornecida por:
a) uma latinha de refrigerante light – 350 mL (2,5 kcal).
b) uma caixinha de água de coco – 300 mL (60 kcal).
c) três biscoitos do tipo água e sal – 18g (75 kcal).
d) uma garrafa de bebida isotônica – 473 mL (113 kcal).
e) um hambúrguer, uma porção de batata frita e um refrigerante de 300 mL (530 kcal).
(Considere o calor específico da água = 1 cal/g°C e sua densidade = 1 g/mL.)
37-(UNESP-SP) Na cozinha de um restaurante há dois caldeirões com água, um a 20oC e outro a

80oC. Quantos litros se devem pegar de cada um, de modo a resultarem, após mistura, 10 litros de água a 26oC?
38-(UnB-DF) O sistema de freios de veículos transforma a energia mecânica em energia térmica e, se ele não dissipar calor, a sua temperatura pode atingir o ponto de fusão dos materiais que o compõem, tornando-o inoperante. Considere um caminhão de 30 toneladas deslocando-se na horizontal a uma velocidade de 72km/h, que tem os freios acionados até parar. Suponha que toda energia cinética seja convertida em calor em seus seis conjuntos de freios, que possuem uma massa de 8kg cada um e calor específico 1.500 J.kg-1.oC-1, sem que haja fusão de seus componentes. Calcule, em graus celsius, o aumento de temperatura de cada um dos seis conjuntos de freios. Despreze a parte fracionária de seu resultado, caso exista.
39-(MACKENZIE-SP) Um calorímetro de capacidade térmica 6 cal/°C contém 80 g de água (calor específico = 1 cal/g°C) a 20°C. Ao se colocar um bloco metálico de capacidade térmica 60 cal/°C, a 100°C, no interior desse calorímetro, verificou-se que a temperatura final de equilíbrio térmico é 50°C. A quantidade de calor perdida para o ambiente, nesse processo, foi de:
![]()
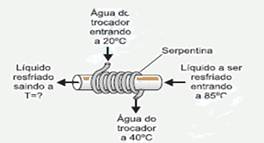
40-(FUVEST-SP) Um trocador de calor consiste em uma serpentina, pela qual circulam 18 litros de água por minuto. A água entra na serpentina à temperatura ambiente (20 °C) e sai mais quente. Com isso, resfria-se o líquido que passa por uma tubulação principal, na qual a serpentina está enrolada. Em uma fábrica, o líquido a ser resfriado na tubulação principal é também água, a 85 °C, mantida a uma vazão de 12 litros por minuto. Quando a temperatura de saída da água da serpentina for 40 °C, será possível estimar que a água da tubulação principal esteja saindo a uma temperatura T de, aproximadamente,
![]()
41-(FGV-SP) Como não ia tomar banho naquele momento, um senhor decidiu adiantar o processo de enchimento de seu ofurô (espécie de banheira oriental), deixando-o parcialmente cheio. Abriu o registro de água fria que verte 8
litros de água por minuto e deixou-o derramar água à temperatura de 20 °C, durante 10 minutos. No momento em que for tomar seu banho, esse senhor abrirá a outra torneira que fornece água quente a 70 °C e que é semelhante à primeira, despejando água na mesma proporção de 8 litros por minuto sobre a água já existente no ofurô, ainda à temperatura de 20 °C. Para que a temperatura da água do banho seja de 30 °C, desconsiderando perdas de calor para o ambiente e o ofurô, pode-se estimar que o tempo que deve ser mantida aberta a torneira de água quente deve ser, em minutos,
![]()
42-(UNICAMP-SP) Desconfiada de que o anel que ganhara do namorado não era uma liga de ouro de boa qualidade, uma estudante resolveu tirar a dúvida, valendo-se de um experimento de calorimetria baseado no fato de que metais diferentes possuem diferentes calores específicos. Inicialmente, a estudante deixou o anel de 4,0 g por um longo tempo dentro de uma vasilha com
água fervente (100 °C). Tirou, então, o anel dessa vasilha e o mergulhou em um outro recipiente, bem isolado termicamente, contendo 2 ml de água a 15 °C. Mediu a temperatura final da água em equilíbrio térmico com o anel. O calor específico da água é igual a 1,0 cal/g°C, e sua densidade é igual a 1,0 g/cm3. Despreze a troca de calor entre a água e o recipiente.
a) Sabendo-se que o calor específico do ouro é c(Au) = 0,03 cal/g°C, qual deveria ser a temperatura final de equilíbrio se o anel fosse de ouro puro?
b) A temperatura final de equilíbrio medida pela estudante foi de 22 °C. Encontre o calor específico do anel.
c) A partir do gráfico e da tabela a seguir, determine qual é a porcentagem de ouro do anel e quantos quilates ele tem.
43-(UFU-MG) As temperaturas iniciais de uma massa m de um líquido A, 2m de um líquido B e 3m de um líquido C são respectivamente iguais a 60oC, 40oC e 20oC. Misturando-se os líquidos A e C, a temperatura de equilíbrio é 30oC; misturando-se os líquidos B e C, a temperatura de equilíbrio é 25oC.
a) Qual é a temperatura de equilíbrio, quando se misturam os líquidos A e B?
b) Se o calor específico do líquido C é 0,5cal/goC, qual é o calor específico do líquido B?
44- (UFC-CE) Três recipientes A, B e C contêm, respectivamente, massas m, m/2 e m/4 de um mesmo líquido. No recipiente A, o líquido encontra-se a uma temperatura T; no recipiente B, a uma temperatura T/2; no recipiente C, a uma temperatura T/4. Os três líquidos são misturados, sem que haja perda de calor, atingindo uma temperatura final de equilíbrio Tf. Assinale a alternativa que contém o valor correto de Tf.
a) T/2.
b) 3T/4.
c) 3T/8.
d) 5T/16.
45-(UFC-CE) X recipientes, n1, n2, n3 …, nx , contêm, respectivamente, massas m a uma temperatura T, m/2 a uma temperatura T/2, m/4 a uma temperatura T/4 …, m/2x -1 a uma temperatura T/2x -1, de um mesmo líquido. Os líquidos dos X recipientes são misturados, sem que haja perda de calor, atingindo uma temperatura final de equilíbrio Tf.
a) Determine Tf, em função do número de recipientes X.
b) Determine Tf, se o número de recipientes for infinito.
46-(UNIFESP-SP) O gráfico mostra as curvas de quantidade de calor absorvido em função da temperatura para dois corpos distintos: um bloco de metal e certa quantidade de líquido.
O bloco de metal, a 115oC, foi colocado em contato com o líquido, a 10oC, em um recipiente ideal e isolado termicamente. Considerando que ocorreu troca de calor somente entre o bloco e o líquido, e que este não se evaporou, o equilíbrio térmico ocorrerá a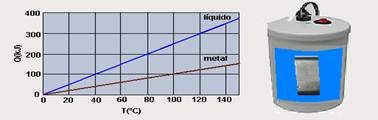
![]()
47-(UERJ-RJ) A tabela abaixo mostra apenas alguns valores, omitindo outros, para três grandezas associadas a cinco diferentes objetos sólidos:
![]() massa;
massa;
![]() calor específico;
calor específico;
![]() energia recebida ao sofrer um aumento de temperatura de 10 ºC.
energia recebida ao sofrer um aumento de temperatura de 10 ºC.
A alternativa que indica, respectivamente, o objeto de maior massa, o de maior calor específico e o que recebeu maior quantidade de calor é: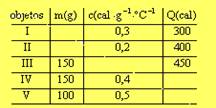
a) I, III e IV
b) I, II e IV
c) II, IV e V
d) II, V e IV
48-(UFG-GO) Um automóvel possui uma mistura aquosa em seu sistema de arrefecimento. Essa mistura é bombeada fazendo circular o calor do motor até o radiador, onde o calor é dissipado para o meio ambiente. Um motorista liga o motor desse automóvel e parte para sua viagem.
Decorridos 10 minutos, ele observa, no indicador de temperatura do painel, que a mistura chega ao radiador com 90 ºC e permanece em torno desse valor durante a viagem. Isso ocorre porque
a) o radiador dissipa mais calor do que o motor produz.
b) o radiador dissipa mais calor quanto maior a temperatura da mistura aquosa.
c) o motor libera menos calor quando aquecido acima dessa temperatura.
d) o motor para de produzir calor acima dessa temperatura.
e) o radiador dissipa menos calor acima dessa temperatura.
49-(UFF-RJ) Uma bola de ferro e uma bola de madeira, ambas com a mesma massa e a mesma temperatura, são retiradas de um forno quente e colocadas sobre blocos de gelo.
Marque a opção que descreve o que acontece a seguir.
a) A bola de metal esfria mais rápido e derrete mais gelo.
b) A bola de madeira esfria mais rápido e derrete menos gelo.
c) A bola de metal esfria mais rápido e derrete menos gelo.
d) A bola de metal esfria mais rápido e ambas derretem a mesma quantidade de gelo.
e) Ambas levam o mesmo tempo para esfriar e derretem a mesma quantidade de gelo.
50- (UERJ-RJ) O gráfico a seguir assinala a média das temperaturas mínimas e máximas nas capitais de alguns países europeus, medidas em graus Celsius.
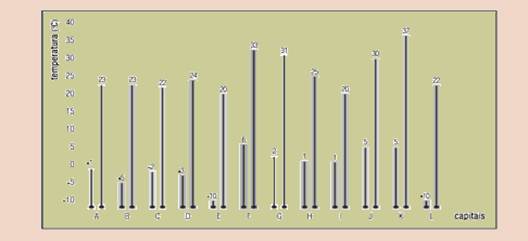
Adaptado de Factos e números essenciais sobre a
Europa e os europeus. Luxemburgo: Serviço das Publicações
Oficiais das Comunidades Europeias, 2006.
Considere a necessidade de aquecer 500 g de água de 0 ºC até a temperatura média máxima de cada uma das capitais.
Determine em quantas dessas capitais são necessárias mais de 12 kcal para esse aquecimento.
51-(UNIFOR-CE) Um pai, ao sair de sua piscina (Largura 4m – Comprimento 10,0m – Profundidade 1,2 m) para brincar com seu filho na piscina conjugada (Largura 2,0 – Comprimento 3,0 m – Profundidade 0,50m ), notou que a temperatura da água na piscina infantil era maior do que a temperatura na sua piscina, muito embora as duas piscinas estivessem expostas ao mesmo sol. Esta situação é possível ou impossível porque
a) impossível, visto que ambas as piscinas estão sob o mesmo sol;
b) possível, visto que os comprimentos das piscinas são diferentes;
c) possível, visto que as profundidades das piscinas são diferentes;
d) possível, visto que as larguras das piscinas são diferentes;
e) possível, visto que uma piscina é maior que a outra.
52-(UEPG-PR) Quanto à transferência de energia térmica, assinale o que for correto.
01. Corpos diferentes apresentarão temperaturas diferentes após recebimento de calor num determinado tempo.
02. A energia cinética média das partículas individuais está diretamente relacionada com a temperatura de uma substância.
04. Quanto maior o calor específico de uma substância, maior será a dificuldade em fazer variar a sua temperatura.
08. O calor específico é de maior valor nas substâncias sólidas do que nas substâncias líquidas.
53-(FGV-SP) A primeira coisa que o vendedor de churros providencia é o aquecimento dos 4 litros de óleo de fritura que cabem em sua fritadeira. A partir de 20 ºC, levam-se 12 minutos para que a temperatura do óleo chegue a 200 ºC, aquecimento obtido por um único queimador (boca de fogão), de fluxo constante, instalado em seu carrinho.
Admitindo que 80% do calor proveniente do queimador seja efetivamente utilizado no aquecimento do óleo, pode-se determinar que o fluxo de energia térmica proveniente desse pequeno fogão, em kcal/h, é, aproximadamente,
Dados: densidade do óleo = 0,9 kg/L — calor específico do óleo = 0,5 cal/(g.ºC)
a) 4 000.
b) 3 500.
c) 3 000.
d) 2 500.
e)2 000.
54-(UEPB) Um forno de microondas produz ondas eletromagnéticas de frequência aproximadamente a 2500 MHz (2,5 × 109 Hz) que é gerada por um magnétron e irradiada por um ventilador de metal, que fica localizado na parte superior do aparelho, para o interior do mesmo. Através do processo de ressonância, as moléculas de água existentes nos alimentos absorvem essas ondas, as quais fazem aumentar a agitação das mesmas, provocando assim o aquecimento dos alimentos de fora para dentro. Veja o esquema abaixo.
Fonte: www.brasilescola.com/fisica/forno-microondas.htm (com adaptações)
Acerca do assunto tratado no texto, resolva a seguinte situação problema: Em um forno de microondas é colocado meio litro de água (500 g) a uma temperatura de 30 °C. Suponha que as microondas produzem 10.000 cal/min na água e despreze a capacidade térmica do copo. Sabendo-se que o calor específico da água é de 1,0 cal/g °C, o tempo necessário para aquecer meio litro de água, em minutos, a uma temperatura de 80 °C, é
![]()
55-(UNIMONTES-MG) No interior de um calorímetro ideal, encontram-se 250 g de água em equilíbrio térmico a 10 ºC. São colocados dentro do calorímetro dois blocos de metal, um de cobre de massa 50 g, a 80 ºC, e outro com massa 50 g, feito de material sem identificação, a 100 ºC. O sistema estabiliza-se a uma temperatura final de 20cºC. O calor específico do bloco feito do material sem identificação, em cal/gºC, é igual, aproximadamente, a
Dados: Calor específico da água = 1,000 cal/gºC Calor específico do cobre = 0,0924 cal/gºC
![]()
56- (UFSCAR-SP) Estima-se que hoje em dia o Brasil tenha cerca de 160 milhões de telefones celulares em operação. Esses aparelhos tão populares utilizam a radiação na frequência das micro-ondas para enviar e receber as informações das chamadas telefônicas.

a) A empresa Darkness de telefonia opera a uma frequência de 850 MHz. Calcule o comprimento de onda λ utilizado pela operadora de telefonia, sabendo que s ondas eletromagnéticas se propagam com a velocidade da luz (c = 3,0.108 m/s).
b) Considere um aparelho celular que emite 1 W de potência quando em funcionamento. Um grupo de pesquisadores deseja estudar o quanto esse aparelho celular provoca de aquecimento na cabeça dos seus usuários. Para tanto, realizam uma simulação num laboratório: enchem uma bexiga de festa, de massa desprezível, com um dado líquido, tal que o conjunto (bexiga+líquido) tenha massa de 2 kg. Em seguida, ligam o telefone celular, encostado no conjunto, pelo tempo total de 9 minutos. Faça uma estimativa da elevação da temperatura do conjunto, após esse intervalo de tempo, considerando que a potência emitida pelo aparelho celular seja absorvida pelo conjunto.
Dado: O calor específico do líquido utilizado na simulação é de 3,6 J/(g °C).
57- (FUVEST-SP) Energia térmica, obtida a partir da conversão de energia solar, pode ser armazenada em grandes recipientes isolados, contendo sais fundidos em altas temperaturas. Para isso, pode-se utilizar o sal nitrato de sódio (NaNO3), aumentando sua temperatura de 300 ºC para 550 ºC, fazendo-se assim uma reserva para períodos sem insolação.
Essa energia armazenada poderá ser recuperada, com a temperatura do sal retornando a 300 ºC. Para armazenar a mesma quantidade de energia que seria obtida com a queima de 1 L de gasolina, necessita-se de uma massa de NaNO3 igual a
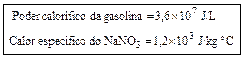
a) 4,32 kg.
b)120 kg.
c) 240 kg.
d) 3 × 104 kg.
e) 3,6 × 104 kg.
58-(UNICAMP-SP) Em determinados meses do ano observa-se significativo aumento do número de estrelas cadentes em certas regiões do céu, número que chega a ser da ordem de uma centena de estrelas cadentes por hora.

Esse fenômeno é chamado de chuva de meteoros ou chuva de estrelas cadentes, e as mais importantes são as chuvas de Perseidas e de Leônidas. Isso ocorre quando a Terra cruza a órbita de algum cometa que deixou uma nuvem de partículas no seu caminho. Na sua maioria, essas partículas são pequenas como grãos de poeira, e, ao penetrarem na atmosfera da Terra, são aquecidas pelo atrito com o ar e produzem os rastros de luz observados.
a) Uma partícula entra na atmosfera terrestre e é completamente freada pela força de atrito com o ar após se deslocar por uma distância de 1 ,5 km . Se sua energia cinética inicial é igual a Ec = 4,5 × 104 J, qual é o módulo da força de atrito média? Despreze o trabalho do peso nesse deslocamento.
b) Considere que uma partícula de massa m = 0,1 g sofre um aumento de temperatura de Dq = 2400 ºC após entrar na atmosfera. Calcule a quantidade de calor necessária para produzir essa elevação de temperatura se o calor específico do material que compõe a partícula é c=0,90 J/goC.
59-(PUC-RS) Para responder a questão, leia as informações a seguir e analise as afirmativas.
Pensando em tomar chimarrão, um gaúcho usa um ebulidor (ou resistência elétrica) para aquecer 1,0 kg de água, de 30oC até 80oC.
O ebulidor foi conectado a uma tensão de 100 V. O processo de aquecimento acontece em 10 minutos. Considera-se que o calor específico da água é 4,2 x 103 J/kgoC.
Sobre o processo descrito acima, afirma-se:
I. A energia absorvida pela água no processo é de 2,1 x 105 J.
II. Desprezando quaisquer trocas de energia, a não ser as que ocorrem entre a água e o ebulidor, a potência elétrica requerida pelo ebulidor é de 2,1 x 104 W.
III. A resistência elétrica do ebulidor é maior do que 2,5 x 101 Ώ.
A(s) afirmativa(s) correta(s) é/são
a) II, apenas.
b) I e II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
60-(UFRGS) Um corpo de alumínio e outro de ferro possuem massas mAl e mFerrespectivamente. Considere que o calor específico do alumínio é o dobro do calor específico do ferro.

Se os dois corpos, ao receberem a mesma quantidade de calor Q, sofrem a mesma variação de temperatura ∆T, as massas dos corpos são tais que
a) mAl = 4mFe.
b) mAl = 2mFe.
c) mAl = mFe.
d) mAl = mFe/2.
e) mAl = mFe/4.
61-(UFRJ-RJ) Um calorímetro ideal contém uma certa massa de um líquido A a 300K de temperatura. Um outro calorímetro, idêntico ao primeiro, contém a mesma massa de um líquido B à mesma temperatura.
Duas esferas metálicas idênticas, ambas a 400K de temperatura, são introduzidas nos calorímetros, uma no líquido A, outra no líquido B.

Atingido o equilíbrio térmico em ambos os calorímetros, observa-se que a temperatura do líquido A aumentou para 360K e a do líquido B, para 320K.
Sabendo que as trocas de calor ocorrem a pressão constante, calcule a razão cA/cB entre o calor específico cA do líquido A e o calor específico cB do líquido B.
62-(CPS) Os manuais de aparelhos celulares recomendam que estes permaneçam distantes do corpo por pelo menos 2,5 cm, pois a Organização Mundial de Saúde (OMS) divulgou um relatório sobre o impacto, na saúde humana, da radiação emitida por estes
aparelhos, informando que os sinais emitidos por eles conseguem penetrar até 1 cm nos tecidos humanos, provocando um aumento de temperatura.
Considere que:
![]() os sinais emitidos pelos celulares têm, em média, potência de 0,5 W e são gerados apenas durante o uso do telefone;
os sinais emitidos pelos celulares têm, em média, potência de 0,5 W e são gerados apenas durante o uso do telefone;
![]() 1 W (um watt) = 1 J/s ( um joule de energia por segundo);
1 W (um watt) = 1 J/s ( um joule de energia por segundo);
![]() o calor específico da água vale 4,2 J/g°C, ou seja, são necessários 4,2 J para variar em 1º C a temperatura de 1 g de água.
o calor específico da água vale 4,2 J/g°C, ou seja, são necessários 4,2 J para variar em 1º C a temperatura de 1 g de água.
Supondo que a radiação emitida por um desses aparelhos seja usada para aquecer 100 g de água e que apenas 50% da energia emitida pelo celular seja aproveitada para tal, o tempo necessário para elevar a temperatura dessa quantidade de água de 1ºC será de
a) 10 min.
b) 19 min.
c) 23 min.
d) 28 min.
e) 56 min.
63-(PUC-MG)
SUPERCONDUTIVIDADE
O termo supercondutividade se refere à capacidade que alguns materiais têm de conduzir a corrente elétrica sem que ocorram perdas de energia na forma de calor.
O QUE FAZ UM CONDUTOR SER SUPER?
A história dos semicondutores já é quase centenária e começa em 1911 com o físico Heike Kamerling Onnes, que observou o fenômeno no mercúrio resfriado a 4,2 K. Em 1995, compostos de cobre dopados com tálio exibiram o fenômeno da supercondutividade a temperaturas de 138 K a pressões ambientes e até a temperaturas de 164 K em altas pressões.

Em um condutor comum, os elétrons da corrente elétrica são continuamente espalhados pelos íons metálicos do fio, perdendo energia, que aquece o fio, fenômeno conhecido como efeito joule. Em um supercondutor, esses elétrons combinam-se e formam os chamados pares de Cooper, unidos por uma interação atrativa, e movem-se sem haver espalhamento.
(Texto adaptado de Scientific American Brasil, ano 8 numero 88, págs. 48-55.)
Essa energia perdida seria capaz de aquecer até 100ºC, aproximadamente quantos quilogramas de água inicialmente a 28 ºC?
Dado: c = 4200 J/kg.oC
a) 3,5 x 103kg
b) 1,2 x 103 kg
c) 4,5 x 105 Kg
d) 1,0 x 106kg
64- UFSM-RS)

Diz a lenda que o imperador Shen Nang descansava sob uma árvore, quando algumas folhas caíram no recipiente em que seus servos ferviam água para beber. Atraído pelo aroma, o imperador provou o líquido e gostou. Nascia, assim, a tecnologia do preparo do chá.
Num dia de inverno, a temperatura ambiente está em 9°C. Faz-se, então, um chá, colocando-se 150 g de água a 100°C numa

xícara de porcelana, à temperatura ambiente. Sabe-se que a porcelana tem calor específico cinco vezes menor do que o da água. Se não houver perdas de energia para a vizinhança e a xícara tiver massa de 125 g, a temperatura da água, quando o equilíbrio térmico com a xícara se estabelece, é de, em °C,
a) 54,5.
b) 72.
c) 87.
d) 89,4.
e) 118,2.
65-(UEPG-PR)

Quanto à transferência de energia térmica, assinale o que for correto.
01) Corpos diferentes apresentarão temperaturas diferentes após recebimento de calor num determinado tempo.
02) A energia cinética média das partículas individuais está diretamente relacionada com a temperatura de uma substância.
04) Quanto maior o calor específico de uma substância, maior será a dificuldade em fazer variar a sua temperatura.
08) O calor específico é de maior valor nas substâncias sólidas do que nas substâncias líquidas.
66-(UNESP-SP)

As pontes de hidrogênio entre moléculas de água são mais fracas que a ligação covalente entre o átomo de oxigênio e os átomos de hidrogênio. No entanto, o número de ligações de hidrogênio é tão grande (bilhões de moléculas em uma única gota de água) que estas exercem grande influência sobre as propriedades da água, como, por exemplo, os altos valores do calor específico, do calor de vaporização e de solidificação da água. Os altos valores do calor específico e do calor de vaporização da água são fundamentais no processo de regulação de temperatura do corpo humano. O corpo humano dissipa energia, sob atividade normal por meio do metabolismo, equivalente a uma lâmpada de 100 W.
Se em uma pessoa de massa 60 kg todos os mecanismos de regulação de temperatura parassem de funcionar, haveria um aumento de temperatura de seu corpo. Supondo que todo o corpo é feito de água, em quanto tempo, aproximadamente, essa pessoa teria a temperatura de seu corpo elevada em 5 ºC?
Dado: calor específico da água ![]() 4,2 x 103 J/kg·ºC.
4,2 x 103 J/kg·ºC.
a) 1,5 h.
b) 2,0 h.
c) 3,5 h.
d) 4,0 h.
e) 5,5 h.
67-(IFSP-SP)

A temperatura normal do corpo humano é de 36,5 °C. Considere uma pessoa de 80 Kg de massa e que esteja com febre a uma temperatura de 40°C. Admitindo que o corpo seja feito basicamente de água, podemos dizer que a quantidade de energia, emquilocalorias (kcal), que o corpo dessa pessoa gastou para elevar sua temperatura até este estado febril, deve ser mais próxima de: Dado: calor específico da água c = 1,0 cal/g°C
a) 200.
b) 280.
c) 320.
d) 360.
e) 420.
68-(UNICAMP-SP)

Em abril de 2010, erupções vulcânicas na Islândia paralisaram aeroportos em vários países da Europa. Além do risco da falta

de visibilidade, as cinzas dos vulcões podem afetar os motores dos aviões, pois contêm materiais que se fixam nas pás de saída, causando problemas no funcionamento do motor a jato.
Considere que o calor específico de um material presente nas cinzas seja c = 0,8 J/goC . Supondo que esse material entra na turbina a −200oC, a energia cedida a uma massa m = 5g do material para que ele atinja uma temperatura de 8.800C é igual a
![]()
69-(UNESP-SP)

Foi realizada uma experiência em que se utilizava uma lâmpada de incandescência para, ao mesmo tempo, aquecer 100 g de água e 100 g de areia. Sabe-se que, aproximadamente, 1 cal = 4 J e que o calor específico da água é de 1cal/gºC e o da areia é 0,2 cal/gºC. Durante 1 hora, a água e a areia receberam a mesma quantidade de energia da lâmpada, 3,6 kJ, e verificou-se que a água variou sua temperatura em 8ºC e a areia em 30ºC. Podemos afirmar que a água e a areia, durante essa hora, perderam, respectivamente, a quantidade de energia para o meio, em kJ, igual a
a) 0,4 e 3,0.
b) 2,4 e 3,6.
c) 0,4 e 1,2.
d) 1,2 e 0,4.
e) 3,6 e 2,4.
70-(UNIFESP-SP)


Um calorímetro de capacidade térmica 10 cal/oC, contendo 500 g de água a 20 oC, é utilizado para determinação do calorespecífico de uma barra de liga metálica de 200 g, a ser utilizada como fundo de panelas para cozimento. A barra é inicialmente
aquecida a 80oC e imediatamente colocada dentro do calorímetro, isolado termicamente. Considerando o calor específico da
água 1,0 cal/(goC) e que a temperatura de equilíbrio térmico atingida no calorímetro foi 30oC , determine:
a) a quantidade de calor absorvido pelo calorímetro e a quantidade de calor absorvido pela água.
b) a temperatura final e o calor específico da barra
71-(UNESP-SP)

Clarice colocou em uma xícara 50 mL de café a 80 °C, 100 mL de leite a 50 °C e, para cuidar de sua forma física, adoçou com 2 mL de adoçante líquido a 20 °C. Sabe-se que o calor específico do café vale 1 cal/(g.°C), do leite vale 0,9 cal/(g.°C), do adoçante vale 2 cal/(g.°C) e que a capacidade térmica da xícara é desprezível.

Considerando que as densidades do leite, do café e do adoçante sejam iguais e que a perda de calor para a atmosfera é desprezível, depois de atingido o equilíbrio térmico, a temperatura final da bebida de Clarice, em °C, estava entre
(A) 75,0 e 85,0.
(B) 65,0 e 74,9.
(C) 55,0 e 64,9.
(D) 45,0 e 54,9.
(E) 35,0 e 44,9
72-(EsPCEx)

Dois blocos metálicos de materiais diferentes e inicialmente à mesma temperatura são aquecidos, absorvem a mesma quantidade de calor e atingem uma mesma temperatura final sem ocorrer mudança de fase. Baseado nessas informações, podemos afirmar que eles possuem o(a) mesmo(a):
[A] densidade.
[B] calor específico.
[C] volume.
[D] capacidade térmica.
[E] massa.
