Resolução comentada dos exercícios de vestibulares sobre Calor específico (sensível) e trocas de calor sem mudança de estado
Resolução comentada dos exercícios de vestibulares sobre
Calor específico (sensível) e trocas de calor sem mudança de estado
01– R- A — veja teoria
02- R- A — veja teoria
03- Observe os dados do gráfico — R- C
04- R- A — veja teoria
05- Observe que eles possuem a mesma massa (m) e recebem a mesma quantidade de calor (Q) — Q=m.c.Δθ — Δθ=Q/m.c — como Q e m são constantes, observe que a variação de temperatura (Δθ) é inversamente proporcional ao calor específico (c) —
R- E
06- 1 minuto – 2 kcal — 60min – Q — Q=60.2 — Q=120 kcal — Q=m.c.Δt — 120=m.1.80 — m=1,5 kg — R- B
07- Pão + hambúrguer — 82,5 + 292,5 — 375,0 kcal
Batata — 50.6=300 ——————— 300,0 kcal
Água de côco —————————— 42,0 kcal
Sorvete — 50.3=150 ——————– 150,0 kcal
Soma — 867,0 — R- E
08- capacidade térmica — C=Q/Δθ=10.55/(45 – 20) — C=22 cal/oC — calor específico — C=m.c — 22=100.c —
c=0,22 cal,g.oC — R- D
09- CX=Q/ΔθX — Q=CX.ΔθX — Q=30CX — CY=Q/ΔθY — Q=CY.ΔθY — Q=60CY — 30CX=60CY — CX=2CY — R- B
10- Q=m.c.Δθ — 3.000=1.000.c.5 — c=3/5 — c=0,6cal/goC
11- a) O asfalto, por ser mais escuro recebe mais calor — R- A
b) Observe no gráfico — Δθmáx=56 – 46 — Δθmáx=10oC
c) cálculo da massa de asfalto — d=m/v — 2,3.103=m/(0,1.10.000) — m=2,3.103.103 — m=2,3.106 kg — Q=m.c.Δθ — Q=2,3.106.0,75.103.(58 – 30) — Q=48,3.109J=4,83.107kJ
12- Entre -10oC e 0oC — Q=m.c.Δθ — 100=m.c.(0 – (-10)) — m.c=10 — entre 0oC e 10oC — (Q1 – 100)=m.c.Δθ —
(Q1 – 100)=10.10 — Q1=200oC — R- A
13- a) água=40oC — óleo=60oC
b) água — no mesmo tempo de aquecimento, mesmo Q, (t=1,5min) sofre menor variação de temperatura (40oC) contra o óleo (60oC).
14- a) cágua=Q/m(40 – 0) — cóleo=Q/m(60 – 0) — cágua/cóleo=Q/40m x 60m/Q=3/2 — cágua/cóleo=3/2
b) cágua/cóleo=3/2 — 1/cóleo=3/2 — cóleo=2/3 cal/goC
15- a) A potencia P dissipada pelo resistor e dada por P = U2/R = 144/100 = 1,44 W — portanto, ao final de uma hora, o calor recebido pelo volume de água será — Q = 1,44 × 3600 = 5,2 × 103 J — Q=5,2.103J
b) De acordo com o gráfico, vemos que a capacidade térmica C correspondente aquela massa de água é — C = Q /ΔT = 1,44 × 3600/12 = 4,32 × 102 J/°C — portanto, a massa será — m = C/c = 4,32 ×102/ 4,2 = 102,8 g — assim sendo, o volume V será V V= m/μ = 102,8/1 — V=102,8 cm3.
16- QA=mA.cA.ΔTA — 20=mA.cA.Δ.40 — mA.cA=1/2 — cA=1/2mA — QB=mB.cB.ΔTB — 40=30mA.cB.Δ.40 — mA.cB=1/30 — cB=1/30mA — cA/cB=1/2mA x 30mA/1 — cA/cB=15
17- Em 20s a fonte térmica fornece — Q=60.20=1.200 cal — Q=m.c.ΔT — 1.200=mc.(60 – 20) — mc=C=30 cal/oC
18- a) CA=QA/ΔθA=300/40 — CA=7,5 J/oC — CB=QB/ΔθB=300/60 — CA=5,0 J/oC
b) cB=2cA — CA=mA.cA — 7,5=mA.cA — CB=mB.cB — 5=mA.cA — 7,5/5=macA/mB.2cA — mA/mB=3
19- Q=m.c.Δt=250.1.80 — Q=20.000 cal — como o microondas fornece 10.000 calorias a cada 1 minuto, ele fornecerá 20.000 calorias em 2 minutos — R- 2 minutos
20- d=m/v — 1,2=m/8 — m=9,5g — Q=m.c.Δt=9,6.0,24.(37-20) — Q=39,68 cal em 1 minuto — em 24h — Q=24x60x39,68 — Q=56.401,92 cal — R- C
21-

22- 01. Correta — quanto menor o calor específico , mais o corpo absorve calor
02. Errada — é maior, pois ela perde menos calor que a terra, por ter maior calor específico
04. Errada — a massa de ar junto à terra, mais aquecida sobe, cedendo lugar a massa de ar mais fria que vem do mar — durante o dia a brisa sopra do mar para a terra — à noite ocorre o contrário.
08- Errada — veja 04
16- Errada — a água resfriou mais lentamente.
32- Correta
64- Errada — possuem calores específicos diferentes.
R- (01 + 32)=33
23- Quantidade de calor absorvida pelo purê — Q=m.c.Δθ=1.000×1,8x(50 – 20) — Q=54.000calx4,18 — Q=225.720J — 80% da potência de 1.200W é transferida para o prato — P=Q/Δt — 0,8×1.200=225.720/Δt — Δt=235,125s/60=3,918 minutos — R- C
24- Se a densidade da água é 1kg/L, a massa de 1L de água é m=1kg — Q=m.c.Δθ=1.000×4,18x(100 – 20) — Q=334.400J — potência do ebulidor — P=Q/Δt=334.400/2×60 — P=2.786,7W — P=U2/R — 2.786,7=1202/R — R=14.400/2.786,7 — R=5,17 Ώ — R- A
25- 40% de 13kg=0,4×13=5,2kg — 6.106cal – 1kg — Q – 5,2kg — Q=6.106x5,2 — Q=31,2.106 cal — Q=m.c.Δt — 31,2.106=m.1.(100 – 20) — m=0,39.106 g=39.104 g — 1L – 103g — xL – 39.104g — x=390 L
26- P=3 kW — Q=m.c.Δt=30×4.200x(60 – 25) — Q=4.410.000 J — P=Q/Δt — 3.000=4.410.000/Δt — Δt=1.470s/60=24,5s —
R- D
27- m1.c.(t – to) + m2.c.(t – to) = 0 — m.c.(te – 70) = 2m.c.(te – 10) = 0 — 3te=90 — te=30oC — R- D
28- ml.cl.(t – to) + ma.ca.(t – to) = 0 — 250.cl.(20 – 40) + 200.1.(20– 0) = 0 — -5.000cl + 4.000 = 0 — cl=0,8 cal/goC
29- mcal.ccal.(t – to) + mágua.cágua.(t – to) + mal.cal.(t – to)=0 — 40.(80 – 90) + 110.1.(80 – 90) + mal.0,2.(80 – 20)=0 — -400 – 1.100 + 12mal=0 — mal=125g
30- mx.cx.(te – tox) + ma.ca.(te – toa) = 0 — 1.000.cx.(40 – 100) + 300.1.(40 – 20) = 0 — 1.000.cx.(-60) + 300.(20) = 0 —
cx=0,1 cal/goC.
31- Primeira experiência — água – Q2=ma.ca.(31 – 20)=1.100ca — objeto – Q1=m.c.(31 – t) — Q2=-Q1 — 1.100ca=mc(t – 31) (I)
Segunda experiência — água – Q2=ma.ca(40 – 20)=2.000ca — objetos – Q1=2mc(40 – t) — Q2=-Q1 — 1.000ca=mc(t – 40) (II)
(I)/(II) — 1.100ca/1.100ca=mc(t – 31)/mc(t – 40) — 11/10=(t – 31)/(t – 40) — 11t – 10t=440 – 310 — t=130oC
32- a) Princípio da Conservação da Energia. Nos sistemas fechados, as trocas internas ocorrem com conservação da quantidade de energia.
b) 10.c.(38 – 32) + m.c.(38 – 100)=0 — 60 – 62m=0 — m=0,97 — V≈1L
33- mar.car.Δt + mágua.cágua.Δt = 0 — mar.0,25.Δt + mágua.1.Δt = 0 — mar/mágua=1/0,25 — R- E
34-

35- a) maf.c.(te –to) + maq.c.(te – to)=0 — 100.c.(30 – 20) + maq.c.(30 – 50)=0 — 100.c.(10) + maq.c.(-20)=0 — maq=50L
b) 0,20L – 1s — 50L – t s — 0,2t=50 — t=250s=4min e 10s
36- dágua=mágua/Vágua — 1=mágua/8×250 — mágua=2.000g (massa de água ingerida) — quantidade de calor fornecida pelo organismo da menina para elevar a temperatura dessa massa de água de 6,5oC até 36,5oC — Q=m.c.(t – to)=2.000.1.30 — Q=60.000cal=60kcal — R- B
37- m1.c.(t – to) + m2.c.(t – to) = 0 — m1.c.(26 – 20) + m2.c.(26 – 80) = 0 — 6m1 – 54m2=0 — m1=9m2 — m1 + m2=10 —
9m2 + m2=10 — m2=1L — m1=9L — um com 9L e outro com 1L.
38- Energia cinética dissipada — Ec=m.V2/2=30.000.(20)2/2 — Ec=6,0.106J — dessa energia, cada freio absorve sob forma de calor — Qfreio=6.106/6 — Qfreio=106J — Qfreio=mfreio.cfreio.Δtfreio — 106=8.1.500. Δtfreio — Δtfreio=83oC
39-
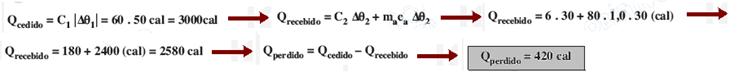
R- A
40-
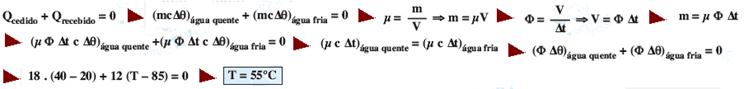
R- C
41-

R- A
42-

43- a) A com C — mA.cA.(t – to) + mC.cC.(t – to) = 0 — m.cA.(30 – 60) + 3m.cC.(30 – 20) = 0 — cA=cC — B com C — 2m.cB.(25 – 40) + 3m.cC.(25 – 20) = 0 — -30cB + 15cC=0 — cB=cC/2 ou cB=cA/2 — A com B — m.cA.(t – 60) + 2mcB.(t – 40)=0 —
m.cA.(t – 60) + 2mcA/2.(t – 40)=0 — t – 60 = 40 – t — t=50oC
b) cC=0,5 cal/goC — cB=cC/2 — cB=0,25 cal/goC
44- m.c.(Tf – T) + m/2.c.(Tf – T/2) + m/4.c.(Tf – T/4) = 0 — Tf – T + Tf/2 – T/4 + Tf/4 – T/16=0 — 28Tf=21T —
Tf=3T/4 — R- B
45- a) A soma dos calores trocados deve ser igual a zero. — Q1 + Q2 + … + QN = 0 — (m.c.DT)1 + (m.c.DT)2 + … + (m.c.DT)N = 0 — Como o líquido é o mesmo em todos os recipientes — (m.DT)1 + (m.DT)2 + … + (m.DT)N = 0 — m.(Tf – T) + (m/2).(Tf – T/2) + …+ (m/2N-1).(Tf – T/2N-1) = 0 — Ssimplificadas as massas m — (Tf – T) + (1/2).(Tf – T/2) + …+ (1/2N-1).(Tf – T/2N-1) = 0 — Tf – T + (1/2).Tf – T/22 + …+ (1/2N-1)Tf – T/22N – 2 = 0 — Tf.[1 + 1/2 + 1/4 +… + 1/2N-1] = T.[1 + 1/4 + 1/16 + … + 1/22N – 2] = 0 — aplicando a soma dos termos de uma PG ![]() S = a1.(qN – 1)/(q – 1) — Tf.2.(1 – 1/2N) = (4T/3).(1 – 1/4N) — Tf.(1 – 1/2N) = (2T/3).(1 – 1/4N) — Tf = (2T/3).(1 – 1/4N)/(1 – 1/2N) b) Para N tendendo a infinito — Tf = (2T/3). (1 – 0)/(1 – 0) = 2T/3
S = a1.(qN – 1)/(q – 1) — Tf.2.(1 – 1/2N) = (4T/3).(1 – 1/4N) — Tf.(1 – 1/2N) = (2T/3).(1 – 1/4N) — Tf = (2T/3).(1 – 1/4N)/(1 – 1/2N) b) Para N tendendo a infinito — Tf = (2T/3). (1 – 0)/(1 – 0) = 2T/3
46- Líquido — Ql=ml.cl.(te – to) — entre 0oC e 120oC — 300.000= ml.cl.(120 – 0) — ml.cl=2.500 — Qm=mm.cm.(te – to) — entre 0oC e 100oC — 100.000= ml.cl.(100 – 0) — ml.cl=1.000 — misturando-os — ml.cl.(te – to) + mm.cm.(te – to) = 0 — 2.500.(te– 10) + 1.000.(te – 115) = 0 — 3.500te = 140.000 — te=40oC — R- E
47- I. Q=m.c.Δθ — 300=m.0,3.10 — m=100g — II. Q=m.c.Δθ — 400=m.0,2.10 — m=200g — III. Q=m.c.Δθ450=150.c.10 — c=0,3 cal/goC — IV. Q=m.c.Δθ — Q=150.0,4.10 — Q= 600cal — V. Q=m.c.Δθ=100.0,5.10 — Q=500cal — R- D
48- R- B
49- O metal tem menor calor específico que a madeira e tem maior facilidade em perder calor, se resfriando mais rápido e liberando menos calor, pois, supondo que o bloco de madeira tenha calor específico dez vezes maior, a capacidade térmica do bloco de madeira será dez maior que a do bloco de chumbo de mesma massa. Como os blocos sofrem a mesma queda de temperatura, o bloco de madeira irá fornecer dez vezes mais calor que o bloco de chumbo e assim sendo irá derreter mais gelo do que o bloco de chumbo — R- C
50- Para um aquecimento de 12.000cal será necessário um aumento de temperatura Δθ de — Q=m.c. Δθ — 12.000=500.1.Δθ — Δθ=24oC — acima de 24oC, pelo gráfico — F, G, H, J e K — 5 capitais
51- Como o calor específico c é o mesmo (água) e ambas recebem a mesma quantidade de calor Q aquele de menor massa sofrerá maior elevação de temperatura — R- C
52- 01. Falsa — depende também da massa dos corpos.
02. Correta — veja teoria.
04. Correta — veja teoria
08- Falsa — é maior nas substâncias líquidas.
R- (02 + 04)=06
53- do=mo/Vo — 0,9=mo/4 — mo=3,6kg — Qo=mo.co.(t – to)=3,6.0,5.(200 – 20) — Qo=324kcal — 80% – 324kcal — 100% – Q — Q=405kcal em 12min=1/5h — Φ=Q/Δt=405/(1/5) — Φ=2.025kcal/h — R- E
54- Q=mc(t – to)=500.1.(80 – 30) — Q=25.000cal — 10.000cal – 1 minuto — 25.000cal – t minutos — t=25.000/10.000 — t=2,5 min — R- B
55- 250.1.(20 – 10) + 50.0,0924.(20 – 80) + 50.c.(20 – 100) = 0 — 2.500 – 277,2 – 4.000c = 0 — c=2.222/4.000=0,5557 cal/goC — R- C
56-
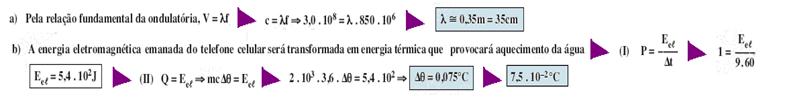
57- Sendo o poder calorífico da gasolina 3,6.107J/L — 1L de gasolina libera Q=3,6.107J de energia térmica que é utilizada no aquecimento de uma massa m de NaN03 — Q=mcΔθ — 3,6.107=m.1,2.103.(550 – 300) — m=120kg — R- B
58-

59- Dados: massa de água — m = 1 kg; variação de temperatura — DT = 80 – 30 = 50 °C; Tensão elétrica — U = 100 V; calor específico da água — c = 4,2´103 J/kg.°C e variação de tempo — Dt = 10 min = 600 s — Testando cada uma das afirmações — I. Correta — Q = mcDT = 1(4,2´103)(50) Þ Q = 2,1´105 J — II. Errada — P = ![]() W —III. Correta — P =
W —III. Correta — P = ![]() W — R- C
W — R- C
60- Dados — QAl = QFe — cAl = 2 cFe — DTAl = DTFe = DT — QAl = QFe — mAl cAlDT = mFe cFe DT — mAl 2 cFe = mFe cFe — mAl = ![]() — R- D
— R- D
61-

62- PT = 0,5 W — h = 50% — m = 100 g — c = 4,2 J/g.°C — quantidade de calor necessária para aquecer a massa de água de 1°C — Q = m c Dt — Q = 100 (4,2) (1) — Q = 420 J — potência útil — Pu = h PT = 0,5 (0,5) = 0,25 W — Pu = ![]() —
— ![]() s — Dt = 28 min — R- D
s — Dt = 28 min — R- D
63- c = 4.200 J — DT = (100 – 28) = 72 °C — Q = DE = 3,6 ´ 108 J — Q = m c DT — m=Q/cΔT=3,6.108/4,2.103.72 —
m = 1.190 kg — m @ 1,2 ´ 103 kg — R- B
64– Qágua + Qporc=0 — máguacágua (t – to) + mporc.c porc..(t – to)=0 — 150.cágua(t – 100) + 125.cágua/5.(t – 9) = 0 — 15t – 15.000 + 25t – 225 = 0 — t=87oC — R- C
65- (01) Falsa — a variação de temperatura depende da quantidade de calor recebida (Q) e da capacidade térmica do corpo (C), de acordo com a expressão ∆t=Q/C — temos, então, que se dois corpos apresentarem a mesma razãoQ/C, apresentarão a mesma variação de temperatura — se estiverem à mesma temperatura inicial, apresentarão a mesma temperatura final.
(02) Correta — temperatura é a medida do estado de agitação das partículas, ou seja, da energia cinética média das partículas.
(04) Correta. A unidade de calor específico é cal/goC — observe nessa unidade que, quanto maior o calor específico, mais energia (calorias) serão necessárias para aumentar de 1 °C uma unidade de massa — o calor específico representa uma espécie de dificuldade da substância em variar temperatura.
(08) Falsa — basta observar aqui que o calor específico da água (líquida) é 1 cal/(g.°C), enquanto que o calor específico do alumínio (sólido) é 0,22 cal/(g.°C).
R- (02 + 04) = 06
66- Dados — P = 100 W — m = 60 kg — c = 4,2.103 J/kg°C — ∆θ =5oC — expressão da potência — P=Q/∆t — P=mc∆θ/∆t — ∆t=60.4,2.103.5/100 — ∆t=12.600s=12.600/3.600 — ∆t=3,5h — R- C
67- Dados — m = 80 kg = 80.000 g — ∆t = 40 – 36,5 = 3,5 °C — c = 1 cal/g°C — equação do calor sensível — Q = m c ∆t — Q = 80.000x1x3,5 = 280.000 cal — Q = 280 kcal — R- B
68- Dados — m = 5 g — c = 0,8 J/g·°C — ∆θ= [880 – (-20)] = 900 °C — equação fundamental da calorimetria — Q = m c ∆θ = (5).(0,8).(900) — Q = 3.600 J — R- D
69-

70- a) Quantidade de calor absorvido pelo calorímetro — temperatura inicial do calorímetro=20oC — temperatura final do calorímetro=30oC — Qc=mc.cc.∆θc — mas mc.cc=Cc — Qc=Cc. ∆θc=10.(30 – 20) — Qc=100 cal — quantidade de calor absorvido pela água — as temperaturas inicial e final da água são as mesmas que do calorímetro — Qa=ma.ca. ∆θa=500.1.(30 – 20) — Qa=5 000 cal.
b) A temperatura final de todos os elementos do sistema é 30oC — não havendo perdas de calor para o meio externo, os três elementos trocam calor apenas entre si — a soma das quantidades de calor trocadas por eles deve ser nula — Qágua + Qcalorímetro + Qbarra = 0 — 5000 + 100 + mb.cb. ∆θb = 0 — 5100 + 200.cb.(30 – 80) = 0 — cb=5100/10000 — cb=0,51cal/goC.
71- Ocorre trocas de calor apenas entre o leite, o café e o adoçante, pois a capacidade térmica da xícara, segundo o enunciado, é desprezível — sendo as densidades as mesmas d=m/V — m=d.V — sendo t a temperatura final da mistura e d a densidade de cada elemento que participa das trocas de calor — não havendo perda de calor para o ambiente, a soma das quantidades de calor trocadas é nula — Qleite + Qcafé + Qadoçante = 0 — mleite.cleite.(t – to) + mcafé.ccafé.(t – to) + madoçante.cadoçante.(t – to) = 0 — d.Vleite.cleite.(t – to) + d.Vcafé.ccafé.(t – to) + d.Vadoçante.cadoçante.(t – to) = 0 — as densidades se cancelam e as unidades mL também podem ser mantidas, pois também se cancelam — 100.0,9.(t – 50) + 50.1.(t – 80) + 2.2.(t – 20) = 0 — 90t – 4 500 + 50t – 4 000 + 4t – 80 = 0 — 144t = 8 580 — t = 59,58oC — R- C
72- Define-se capacidade térmica (C) ou capacidade calorífica de um corpo como sendo o produto da massa desse corpo pelo calor específico da substância de que ele é constituído, ou seja, — C=m.c — como Q=m.c.Δt — Q=C.Δt — ou Q=C/(t – to)

Se, por exemplo, a capacidade térmica de um corpo é C=40cal/oC, isto significa que, quando esse corpo receber ou ceder 40 calorias, sua temperatura aumentará ou diminuirá de 1 oC.
Observe na expressão C=Q/∆t que, de acordo com o enunciado, como Q e ∆t são os mesmos para os dois blocos eles devem possuir a mesma capacidade térmica — R- D.
