Resolução comentada da UEL 2015
RESOLUÇÕES
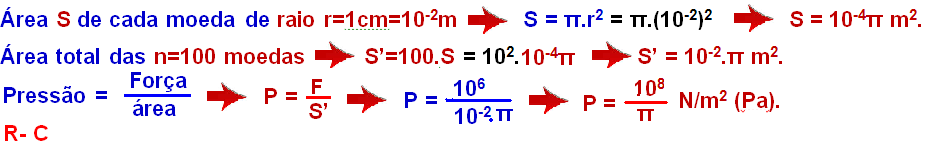
01-
02-
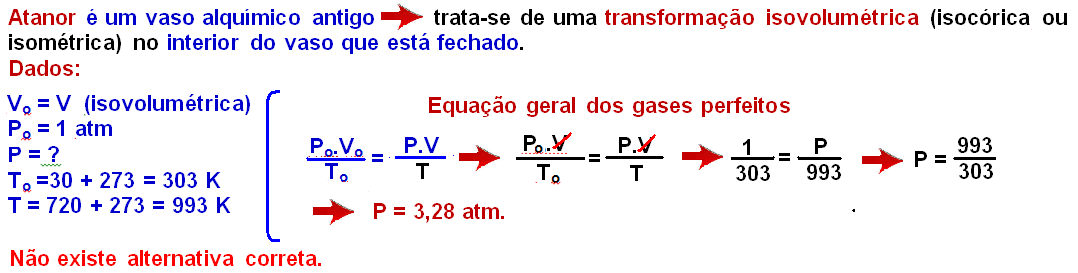
03- ( ) De acordo com o modelo atômico de Rutherford, o átomo é constituído por duas regiões
distintas: o núcleo e a eletrosfera.
(Verdadeira) — O modelo atômico de Rutherford sugeriu então, um átomo com órbitas circulares
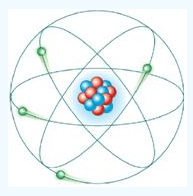
dos elétrons em volta do núcleo. Comparou o átomo com o Sistema Solar, onde os elétrons seriam os planetas e o núcleo seria o Sol.
( ) Thomson propôs um modelo que descrevia o átomo como uma esfera carregada positivamente,
na qual estariam incrustados os elétrons, com carga negativa.
(Verdadeira) — Para Thomson, o átomo era uma esfera de carga elétrica positiva “recheada” de
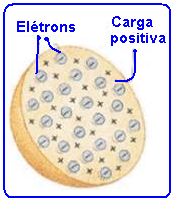
elétrons de carga negativa. Esse modelo ficou conhecido como “pudim de passas”.
( ) No experimento orientado por Rutherford, o desvio das partículas alfa era resultado da sua aproximação com cargas negativas presentes no núcleo do átomo.
(Falsa) — Rutherford concluiu que o átomo tem núcleo positivo (+), já que partículas alfa desviavam algumas vezes.
( ) Ao considerar a carga das partículas básicas (prótons, elétrons e nêutrons), em um átomo
neutro, o número de prótons deve ser superior ao de elétrons.
(Falsa) — ao considerar a carga das partículas básicas (prótons, elétrons e nêutrons), em um átomo neutro, o número de prótons deve ser igual ao de elétrons.
( ) Os átomos de um mesmo elemento químico devem apresentar o mesmo número atômico.
(Verdadeira) — átomos de um mesmo elemento químico apresentam o mesmo número atômico.
R- A
04- Os físicos, Murray Gell-Mann e George Zweig desenvolveram, independentemente, um modelo para classificar as Partículas Elementares. Segundo esse modelo (hoje conhecido como Modelo dos Quarks), os hádrons (bárions, mésons e outras partículas subatômicas) formavam os quarks, que por sua vez eram componentes dos prótons e nêutrons.
R- A
05-
R- E
06-

