Tipos de transformações gasosas
Tipos de transformações gasosas
O estado de qualquer gás é caracterizado pelos valores de três grandezas que são o volume (V), a pressão (P) e a temperatura (T).
São muito comuns as transformações em que ocorrem duas das variáveis de estado, mantendo-se uma constante. Pode-se ter, então:
Transformação isotérmica
Nela, durante todo o processo termodinâmico de um gás ideal, a temperatura permanece constante (isso=igual; thermos = temperatura).
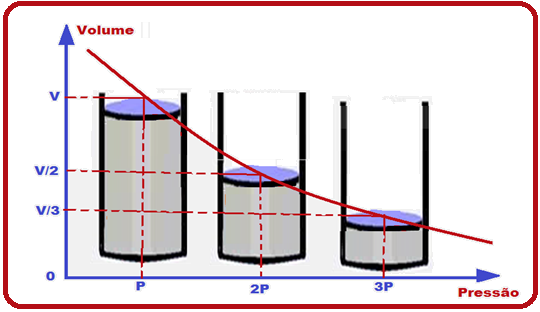
O cientista Robert Boyle comprovou que, quando a temperatura é constante, a pressão (P) exercida por certa massa gasosa é inversamente proporcional ao volume (V) por ela ocupado, ou P.V = constante, ou ainda, Po.Vo = P.V.
Po e Vo representam a pressão e o volume num estado de equilíbrio inicial.
P e V representam a pressão e o volume num estado de equilíbrio final.

Isotermas
Sendo P.V = constante = k ![]() P =
P =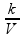 e, se V tende a zero, P cresce indefinidamente e se V cresce indefinidamente P tende a zero.
e, se V tende a zero, P cresce indefinidamente e se V cresce indefinidamente P tende a zero.
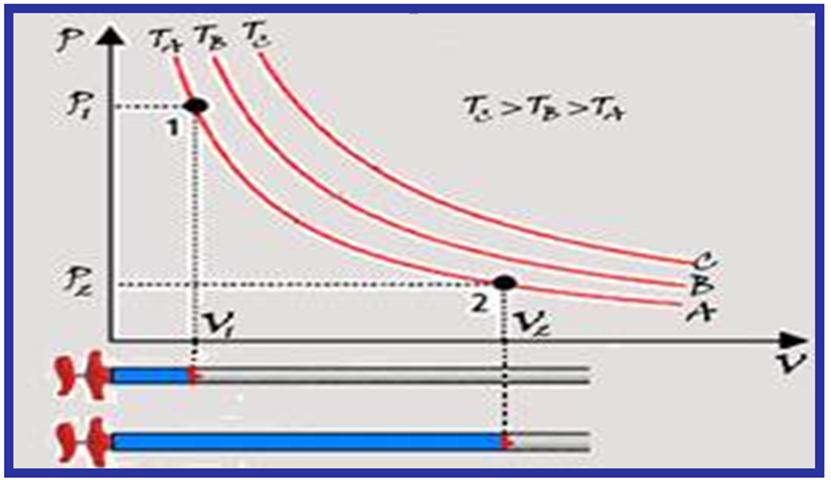
Se você representar graficamente P x V você obterá uma curva de nome isoterma que é um ramo de uma hipérbole eqüilátera.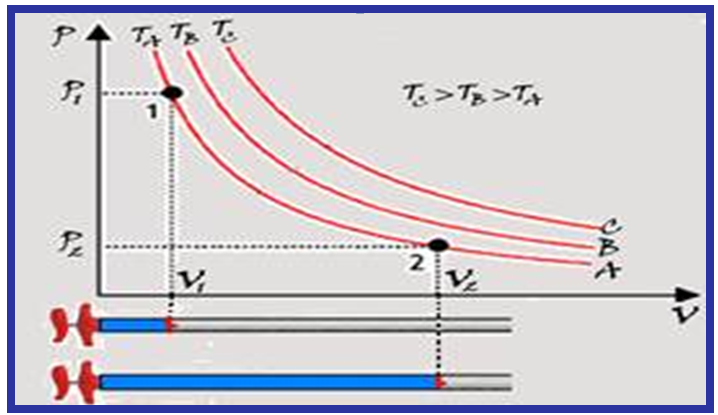
Cada ponto da curva (isoterma) A tem a mesma temperatura (TA); cada ponto da curva (isoterma) B tem a mesma temperatura (TB) e cada ponto da curva (isoterma) C tem a mesma temperatura (TC).
Observe que TC > TB > TA, pois o produto PAVA > PBVB > PCVC e, assim quanto mais afastada dos eixos maior será o valor da temperatura da hipérbole representativa.
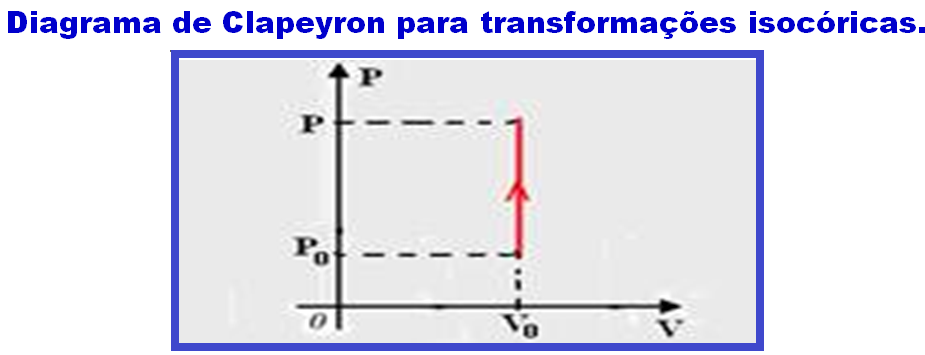
Transformação isocórica, isométrica ou isovolumétrica
Nessa transformação o volume é mantido constante (isso=igual; coros=volume).
Os físicos Jacques Charles e Gay-Lussac descobriram experimentalmente que, numa transformação isocórica, a pressão (P) é diretamente proporcional à temperatura absoluta (T), ou seja:
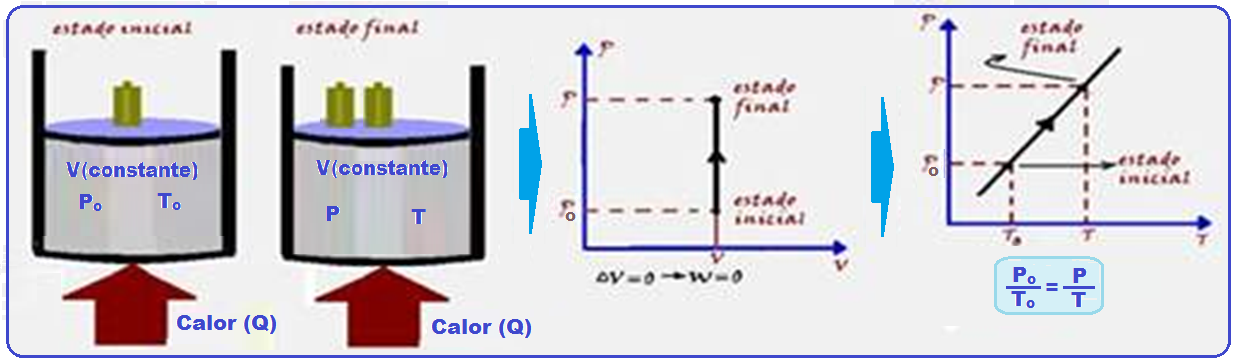
A expressão acima só é válida se considerarmos a temperatura absoluta, isto é, na escala kelvin.
Se a temperatura for medida em graus Celsius, isso não se aplica.
Na expressão P /To = P/T, conhecida como lei de Charles, Po e To representam a pressão e a temperatura absoluta do gás no estado inicial: P e T representam, respectivamente, a pressão e a temperatura absoluta do gás no estado final.
Observe o gráfico abaixo onde você vê representada a lei de Charles (transformação isovolumétrica) que representa a pressão (P) e a temperatura T, medida em graus kelvin (K) para 3 gases 1, 2 e 3.
Como a temperatura de um gás perfeito diminui à medida que a pressão também diminui, então deveria existir uma temperatura muito baixa na qual a pressão seria
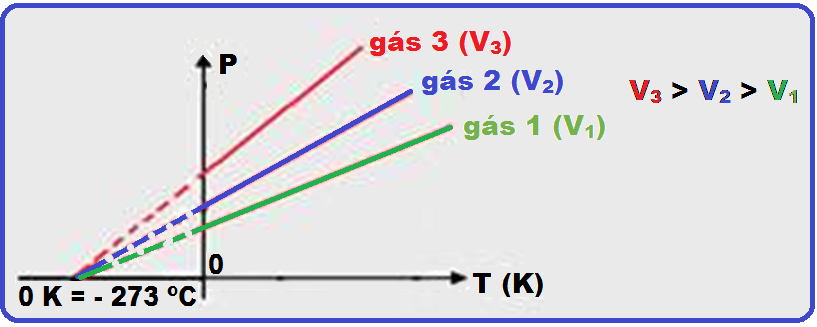
nula, obtida pelo prolongamento dos gráficos acima onde as retas representativas de cada gás convergem para um único ponto: -273,15oC = 0 K, no qual a pressão exercida pelos gases torna-se nula.
Na realidade, esse fenômeno não acontece, pois é impossível se anular a pressão exercida por um gás, pois, com um resfriamento suficiente, todos eles se liquefazem ou se solidificam.
Transformação isobárica
Ocorre à pressão constante (isso=igual; baros=pressão).
O físico Jacques Charles observou que, para uma certa massa de gás perfeito, mantida apressão constante, o volume é diretamente proporcional à temperatura absoluta,ou seja:
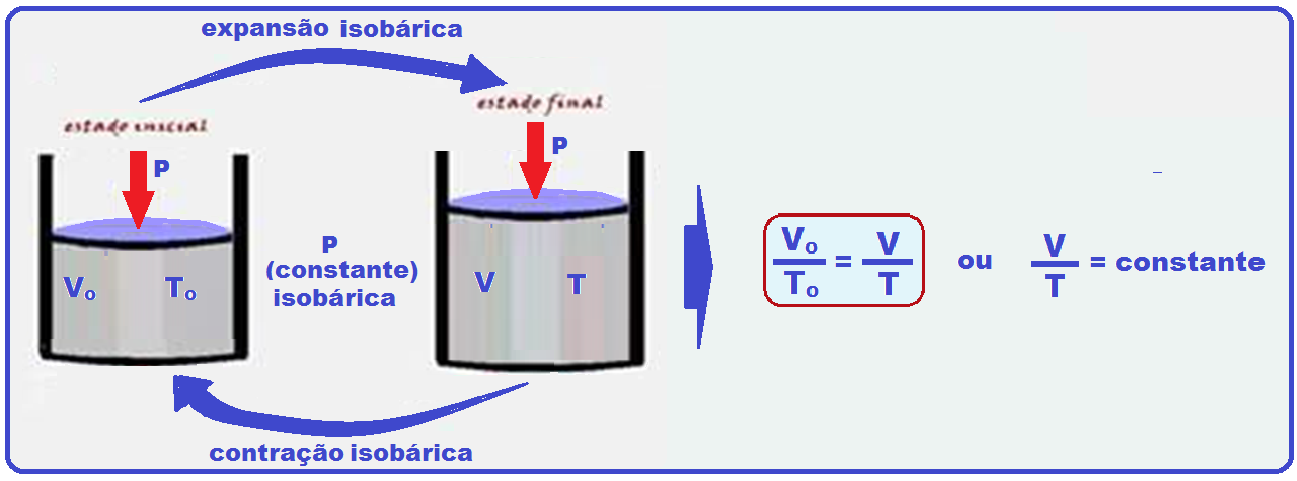
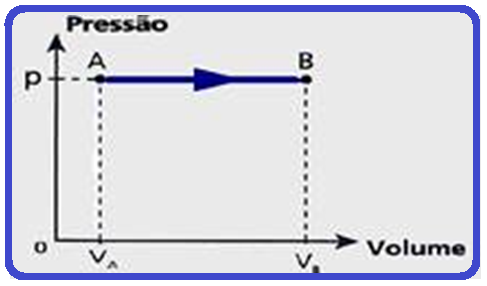
A relação acima é denominada lei de Charles e Gay-Lussac para transformações isobáricas e cujo gráfico V x T stá representado abaixo:
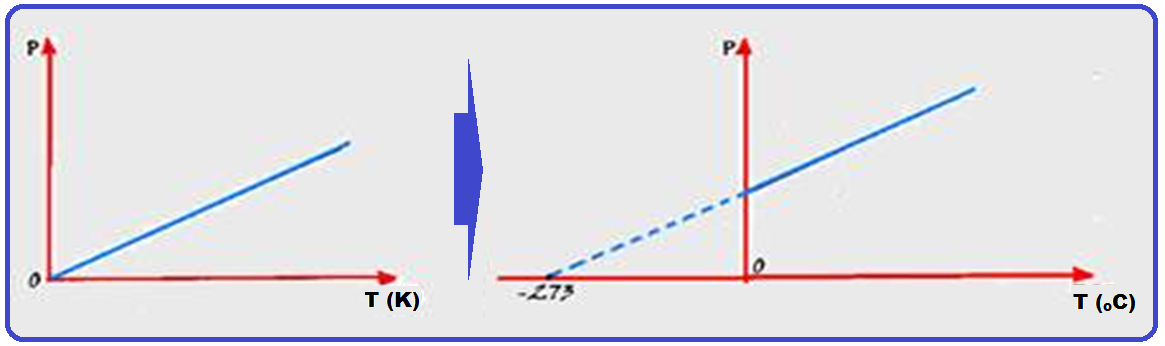
Diagrama de Clapeyron para transformações isobáricas
Equação de Clapeyron
As três leis anteriores mostram como um gás perfeito se comporta quando mantemos uma variável constante e variamos as outras duas.
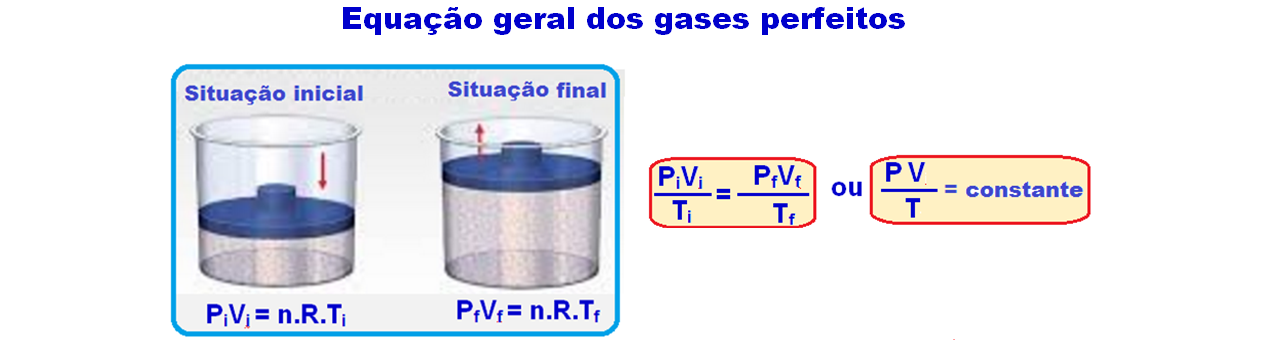
A equação de Clapeyron ou equação de um gás ideal corresponde a uma síntese dessas três leis, que relacionam entre si pressão, temperatura e volume.
Numa transformação isotérmica, pressão e volume são inversamente proporcionais e em uma transformação isométrica, isocórica ou isovolumétrica, pressão e temperatura são diretamente proporcionais.
Pelas informações acima você pode concluir que a pressão é diretamente proporcional à temperatura e inversamente proporcional ao volume.
Acontece que o número de moléculas (número de mols) influencia na pressão exercida pelo gás, ou seja, a pressão também depende diretamente da massa do gás (número de moléculas nele contidas).
Considerando esses resultados, Paul Emile Clapeyron estabeleceu uma relação entre as variáveis de estado com a seguinte expressão matemática:


Equação geral dos gases perfeitos

À equação acima se dá o nome de lei geral dos gases perfeitos e você deve utiliza-la quando houver variação de pressão, volume e temperatura simultaneamente, mantendo-se constante a massa.
O que você deve saber, informações e dicas
![]()
Transformação Isotérmica

Isotermas
![]()
Transformação isocórica, isométrica ou isovolumétrica

![]()
Transformação Isobárica

Equação de Clapeyron ou Equação de um gás ideal
![]()

![]()

![]()


![]()
Nas lições iniciais de um curso de mergulho com equipamento autônomo – cilindro de ar

comprimido – os alunos são instruídos a voltarem lentamente à superfície, sem prender sua respiração em hipótese alguma, a fim de permitir que ocorra a gradativa descompressão (diminuição da pressão).
O aprisionamento do ar nos pulmões pode ser fatal para o mergulhador durante a subida, pois, nesse caso, a transformação sofrida pelo ar nos pulmões é isotérmica, com aumento do volume do ar.
![]()

Como o volume do cilindro que contém o gás se dilata muito pouco com a temperatura, pode-se dizer que se trata de uma transformação gasosa isométrica ou isovolumétrica (volume constante). Como o carro fica exposto ao sol, a temperatura do gás aumenta e conseqüentemente a pressão exercida pelo gás também aumenta, pois P/T = constante e P é diretamente proporcional a T, cujo

gráfico PXT está representado acima.
![]()
Um balão de aniversário, cheio de gás Hélio, solta-se da mão de uma criança, subindo até grandes

altitudes e, devido a redução da pressão, seu volume aumenta.

![]()
Mistura de gases
Considere dois recipientes rígidos, de volumes VA e VB contendo, respectivamente, gases A e B. Esses recipientes estão conectados entre si por um tubo fino munido de torneira que está fechada. Abre-se então a torneira colocando os
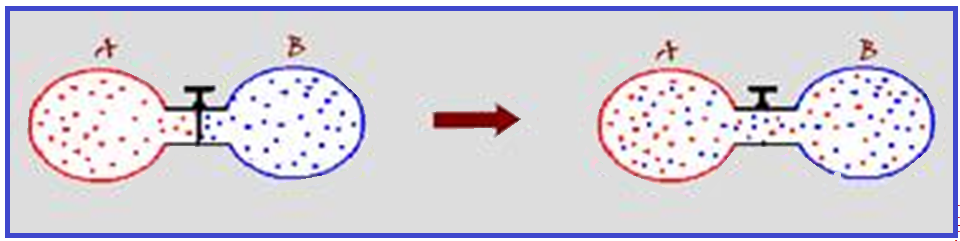
dois recipientes em comunicação, com os gases se misturando.
Após a mistura, suas partículas terão o mesmo grau de agitação, portanto a mesma temperatura.
Considerando n o número de mols da mistura, nA o número de mols do gás A e nB o número de mols do gás B, pode-se escrever ![]() n = nA + nB
n = nA + nB ![]() Clapeyron
Clapeyron ![]() PV = nRT
PV = nRT ![]() n = PV/RT, que,
n = PV/RT, que,
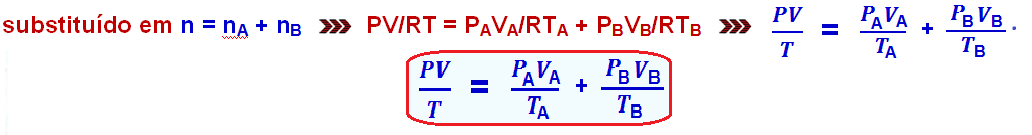
Se PA for a pressão do no recipiente A antes da mistura e PB a pressão no recipiente B antes da mistura, tem-se P = PA + PB, onde P é a pressão total exercida pela mistura.
![]()
Veja um exercício interessante:
Quando abrimos uma geladeira com boa vedação e voltamos a fechá-la, é difícil abri-la novamente em seguida.
a) Como podemos explicar esse fenômeno com base no comportamento termodinâmico dos gases?
b) Considere uma geladeira com volume interno de 1.000 L, temperatura interna -5°C e área da porta 2m2. Num dia cuja temperatura ambiente é 25°C, abrimos a porta da geladeira e a fechamos. Supondo que todo o ar frio no interior da geladeira seja substituído por ar à temperatura ambiente, qual será a força média necessária para abrir a porta depois
de restabelecido o equilíbrio termodinâmico no interior da geladeira?
(Dado: 1 atm ≈ 105 N/m2).
Resolução:
a) Se a porta do freezer fica aberta por algum tempo, parte do ar de seu interior é substituído pelo ar mais quente do exterior.
Depois que você fecha a porta da geladeira, a temperatura interna do ar em seu interior irá diminuir e como se trata de uma isovolumétrica, a pressão também diminui (P/T = constante) fazendo com
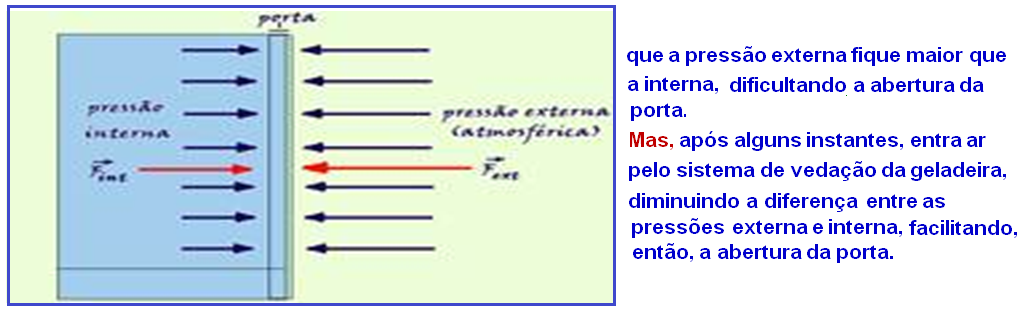
b) Se a pressão externa é maior que a interna, como Pressão = Força/Área da porta, a força externa terá intensidade maior que a força interna e a intensidade da força resultante será FR = Fext – Fint.
A transformação é isovolumétrica (volume constante) ![]() P1/T1 = P2/T2
P1/T1 = P2/T2 ![]() 1,0.105x1.000 = P2/(25 + 273)
1,0.105x1.000 = P2/(25 + 273) ![]() P2 = Pint = 0,9.105N/m2 (Pa)
P2 = Pint = 0,9.105N/m2 (Pa) ![]() ΔP = FR/S
ΔP = FR/S ![]() (1,0.105 – 0,9.105) = FR/2
(1,0.105 – 0,9.105) = FR/2 ![]() FR = 0,2.105N
FR = 0,2.105N ![]() FR=2,0.104 N.
FR=2,0.104 N.
