Resolução comentada dos exercícios de vestibulares sobre a
Segunda Lei da Termodinâmica
01- η=1 – 36/45 — η= 1 – 0,8 — η=0,2=20%
02– a) η = 1 – T1/T= 1 – (0 + 273)/(100 + 273) — η = 1 – 273/373=(373 – 273)/373 — η =0,268 ou η = 26,8%
b) η = 1 – Q1/Q — 0,268= 1 – Q1/1.000 — Q1=732cal
03– η = 1 – T1/T — 0,25= 1 – (27 + 273)/T — 0,75=300/T — T=300/0,75 — T=400K=127oC
04– η = 1- 275/300 — η = 25/300 — η = 0,08 — η = 8%
05- R- V V V V V — veja teoria
06- R- D — veja teoria
07- η=1 –(273 – 73)/(273 + 227)=1 – 200/500 — η=1 – 0,4=0,6 — R- E
08- (01) Falsa — veja teoria
(02) Correta — veja teoria
(04) Falsa — veja teoria
(08) Verdadeira — o rendimento da máquina de Carnot é função exclusiva das temperaturas absolutas das fontes fria e quente e não depende da substância que faz a máquina térmica funcionar.
(16) Verdadeira — veja teoria
R- (02+08+16) = 26
09- 01. Falsa — o ciclo de Carnot indica um rendimento máximo, mas menor que 100%.
02. Verdadeira — η= 1 – (273 + 7)/(273 + 37)= 1 – 0,9 — η=90% — 20%<η
04. Verdadeira — a água apresenta densidade máxima a 4oC.
08. Verdadeira — veja teoria.
16. Falsa — não viola o princípio da conservação da energia.
R- (02 + 04 + 08)=14
10- W=Q1 – │Q2│=3,0.104J — η = W/Q1 — 0,6=3,0.104/Q1 — Q1=5,0.104J — Q1– │Q2│=3,0.104J — 5,0.104 – │Q2│= 3,0.104 — │Q2│= 2,0.104J — primeira lei da termodinâmica — ΔQ=W — ΔU=ΔQ – W — ΔU=3,0.104 – 3,0.104 — ΔU=0 — R- D
11- W= Q1 – Q2 — 800=4.000 – Q2 — Q2=3.200J — η = 1 – Q2/Q1 — η = 1 – 3.200/4.000 — η = 1,0 – 0,8 — η = 0,2 —
η = 1 – T2/T1 — 0,2= 1 – 300/T1 — T1=300/0,8 — T1= 375K — R- A
12- I. Correta — os espaços vazios entre as prateleiras facilitam as correntes de convecção.
II. Falsa — a massa de gelo corresponde a um isolante térmico evitando que o congelador retire calor do interior da geladeira.
III. Correta — o calor retirado do interior da geladeira deve sair pela “grade”.
R- D
13- R- E — veja teoria
14- Com T1=500K e T2=250K, o rendimento máximo dessa máquina valeria — η = 1 – T2/T1=1 – 250/500 — η = 0,5 — se o trabalho produzido por essa máquina fosse W=0,75Q1 e o calor rejeitado fosse Q2=0,25Q1, o rendimento dessa máquina seria — η = Q1 – Q2/Q1 — η = W/Q1=0,75Q1/Q1 — η =0,75 — esse rendimento é impossível, pois é maior que o rendimento de uma máquina de Carnot operando entre as mesmas fontes — R- A
15- No tempo 2, ocorre a compressão: com as válvulas fechadas, o êmbolo sobe, movido pelo virabrequim, comprimindo a mistura ar combustível rapidamente — observe que como a compressão é muito rápida, não ocorre trocas de calor com o meio, portanto o processo é adiabático — R- B
16- η = 1 – X/400 — 1= 1 – X/400 — 0=T/400 — T=0K — R- D — Observação — para o rendimento ser de 100% a temperatura da fonte fria deveria ser a temperatura absoluta 0K (-273oC), o que, de acordo com a segunda lei da Termodinâmica não pode ocorrer — veja teoria de entropia.
17- I. Falsa — temperatura é um número associado ao nível de vibração das moléculas.
II. Verdadeira — veja teoria
III. Verdadeira — adiabática — Q=0 — ΔU=Q – W — ΔU= 0 – W — ΔU=-W — observe que numa expansão — W>0 e, consequentemente ΔU<0.
IV. Falsa — você pode comprimi-lo isotermicamente que sua temperatura aumenta.
R- D
18- a) Transformação Isotérmica: ocorre à temperatura constante — Transformação adiabática: ocorre sem quem haja trocas de calor
b) η=1 – 400/800=1 – ½ — η=0,5=50%
c) Se o rendimento é de 50%, de todo calor recebido essa porcentagem é transformada em trabalho — W=500J
19- η=30/100=0,3 — η = 1 – T2/T1 — 0,3= 1 – T2/T1 — T1=T2/0,7 — T’=2T1 — T’=2T2/0,7 — T’=T2/0,35 — η’=1 – T2/T1 — η’= 1 – T2/(T2/0,35) — η’=1 – 0,35 — η’=0,65 — R- E
20- Cálculo do máximo rendimento dessa máquina — η = 1 – 300/500 — η=1,0 – 0,6 — η = 0,4=40% — nenhuma das máquinas pode ter rendimento superior a 0,4 — A — η =10.000/10.000 — η=1 (não pode, superior a 0,4) — B — η=6.000/12.000 — η=0,5 (não pode, superior a 0,4) — C — η=3.000/8.000 — η=0,375 — (pode, inferior a 0,4) — R- C
21- I. Verdadeira — veja teoria
II. Falsa — como no decorrer do ciclo a temperatura varia, energia interna também variará
III. Falsa — é impossível transformar todo calor recebido em trabalho
R- A
22- R- C — veja teoria
23- 01. Correta — compressão rápida é adiabática (não troca calor com o ambiente) — Q=0 — ΔU=Q – W — ΔU= -W — na compressão o volume diminui e o W é negativo — ΔU= – (-W) — ΔU > 0.
02. Falsa — duas isotérmicas e duas adiabáticas.
04. Falsa — depende também da temperatura da fonte fria.
08. Correta — veja teoria
16. Correta — veja teoria
R- (01 + 08 + 16)=25
24- Temperatura está associada ao numero que mede o movimento oscilatório das moléculas — no compartimento das mais velozes, a temperatura é maior e no das mais lentas, a temperatura é maior — R- A
25- R- E — sempre que o gás se expande, seu volume ao aumentar, produz trabalho positivo.
26- R- A — O Segundo Princípio da Termodinâmica que um sistema isolado tende a evoluir no sentido de aumentar a entropia.
27- Como a entropia refere-se à desordem do sistema, a entropia diminui — R- A
28- a) Utilizando a equação — Ea≈1 – 1/√ra — Ea=1 – 1/√11=1 – 1/(10/3) — Ea=1 – 3/10 — Ea=0,7=70% — Eg≈1 – 1/√rg — Eg=1 – 1/√9=1 – 1/3 — Eg=2/3 — Eg=0,67=67%
b) PfVf/Tf= PiVi/Ti — 30.36/Tf=1.400/300 — Tf=810K
29- R- (01 + 04 + 16) = 21
30- R- D — veja teoria
31-
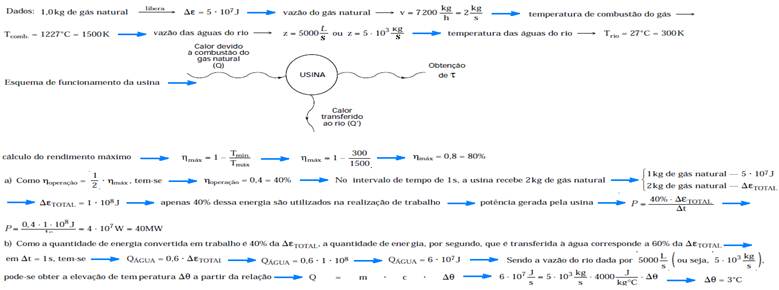
32- I. Falsa — A maior temperatura obtida por uma máquina (motor) térmica é a da combustão, que é a temperatura onde acontece a reação química do carboidrato com o oxigênio do ar, resultando em gás carbônico e água, sem relação nenhuma com a temperatura de fervura.
II. Correta — esta equação é a que fornece o rendimento de uma máquina térmica ideal e pode ser utilizada para análise de rendimento de máquinas reais.
III. Correta — Carnot — “O rendimento de uma máquina térmica não depende do tipo de combustível utilizado, dependendo apenas da temperatura da fonte quente (mais alta) e da fonte fria (mais baixa)”
IV. Correta — Não existe máquina térmica com rendimento de 100%, que consiga transformar integralmente calor em trabalho.
R- E
33-
R- C
34- I. Correta — O refrigerador é uma máquina térmica que transfere calor da fonte fria para a fonte quente.
II. Correta — O refrigerador é uma máquina térmica que usa um líquido refrigerante com processos de condensação e vaporização.
III. Falsa — quanto maior o calor latente de vaporização do líquido refrigerante, menor é o trabalho realizado pelo refrigerador.
IV. Correta — O processo de refrigeração realiza trabalho por meio de um compressor que mantém a circulação do fluido refrigerante, retirando calor da fonte fria e transferindo-o para a fonte quente.
R- D
35– Em um sistema de refrigeração, como uma geladeira ou ar-condicionado, o trabalho é recebido para que o calor oriundo da fonte fria seja transferido para a fonte quente — R– D
36- (01) Correta.
(02) Correta.
(04) Errada. A 2ª lei da termodinâmica afirma que é IMPOSSÍVEL transformar integralmente calor em trabalho.
(08) Correta.
(16) Correta. A variação da energia interna depende somente da temperatura. Se o processo é cíclico, o sistema retorna sempre à temperatura inicial.
R- (01 + 02 + 08 + 16) = 27
37- No ciclo temos as seguintes transformações:
JK — expansão isotérmica. Se a entropia aumenta, o sistema recebe calor e realiza trabalho;
KL — resfriamento adiabático. A temperatura diminui sem variar a entropia, logo não há troca de calor;
LM — compressão isotérmica. A entropia diminui, o sistema perde calor e recebe trabalho;
MJ — aquecimento adiabático. A temperatura aumenta sem variar a entropia — observe que se trata de um ciclo de Carnot, com rendimento — η=1 – T1/T2 — Calculo do trabalho realizado no ciclo, lembrando que a variação da entropia é — ΔS=Q/T, onde Q é o calor trocado na transformação — a transformação JK é isotérmica, portanto a variação da energia interna é nula — da 1ª lei da termodinâmica (
R- B
38- A 2ª Lei da Termodinâmica afirma que nenhuma máquina térmica, operando em ciclos entre uma fonte quente, à temperatura T1, e uma fonte fria, à temperatura T2, consegue transformar integralmente calor em trabalho. Portanto o rendimento nunca pode chegar a 100%, sendo no máximo, igual ao da máquina de Carnot — de fato, analisando o gráfico, vemos que o rendimento seria igual a 100% quando a razão T2/T1 fosse nula, ou seja — T2/T1=0 — T2=0 — a fonte fria teria que estar a 0 K, o que é um absurdo — portanto o rendimento r é sempre menor que 100%.
R- E
39- Dados: T1 = 27 °C = 300 K; Q1 = 40 kJ; W = 10 kJ.
O rendimento (h) desse motor é — η=W/Q1=10/40 — η=0,25=25% — aplicando esse rendimento ao ciclo de Carnot —
h = 1 –
R- A
40- (01) Correta.
(02) Correta.
(04) Errada. A 2ª lei da termodinâmica afirma que é IMPOSSÍVEL transformar integralmente calor em trabalho.
(08) Correta.
(16) Correta. A variação da energia interna depende somente da temperatura. Se o processo é cíclico, o sistema retorna sempre à temperatura inicial.
R- (01 + 02 + 08 + 16) = 27
41- A termodinâmica estabelece que nenhuma máquina operando em ciclos fornece rendimento maior que a máquina ideal de Carnot.Portanto, r < 50% — R- D
42- Se a expansão é isotérmica a energia interna não varia. Sendo o sistema não termicamente isolado, todo calor recebido pelo gás é transformado em trabalho — R- A
43- Respostas das questões de física:
01. Falsa — O ciclo de Carnot é um ciclo teórico que dá o máximo rendimento que uma máquina térmica poderia fornecer — na prática, nenhum motor opera segundo esse ciclo.
04. Falsa — a relação entre força (F) e velocidade (v) depende da potência (P), pois — P = F.V
08. Falsa — o calor de combustão é fornecido pela queima do combustível — a faísca é somente para iniciar a combustão.
16. Correta.
R- (02 + 16 + 64) = 82
44- 01. Resposta de Biologia. O neodarwinismo é a síntese entre a teoria darwinista (séc. XIX) e os conhecimentos de genética (séc. XX).
02. Resposta de Física — Falsa — a equação geral dos gases, afirma que, para uma amostra de gás ideal confinada num recipiente, vale a relação — PV=nRT — através dessa expressão você observa que a teoria geral dos gases ideais é assim resumida: “o produto pressão (P) x volume (V) é diretamente proporcional à temperatura absoluta (T) do gás.” — existe uma única exceção que ocorre numa transformação isotérmica onde a temperatura absoluta é constante e P.V=K e, nesse caso a pressão e o volume são inversamente proporcionais — mas trata-se apenas de um caso particular.
04. Resposta de Física — Falsa — a falta de comunicação entre os componentes da comunidade científica é apenas um dos entraves — existem outros fatores, como por exemplo, falta de investimentos nessas novas tecnologias, dificuldades técnicas na construção de equipamentos para elaboração dos produtos em escala comercial — tecnologia exige tecnologia.
08) Resposta de Física — falsa — a segunda lei da termodinâmica afirma exatamente o contrário: é impossível transformar integralmente calor em trabalho.
16. Resposta de Física — Correta — o transporte de informações através de fibras ópticas é feito por reflexão total no interior da fibra — esse fenômeno só é possível quando o sentido de propagação da luz é do meio mais refringente (núcleo) para o meio menos refringente (revestimento), como indicado na figura abaixo.
32. Resposta de Biologia — a conservação dos alimentos impõe a eliminação ou redução da ação de microrganismos decompositores ou patogênicos como bactérias, fungos e algas — os trabalhos de Pasteur contribuíram para o desenvolvimento de técnicas de conservação dos alimentos.
R- (01 + 16 + 32) = 49.
45- A segunda lei da termodinâmica envolve a transformação de calor em trabalho — dos processos dados, o único que não envolve realização de trabalho é o movimento de um satélite em órbita, pois se trata de um sistema conservativo, já que ocorre no vácuo, não havendo atrito com o ar e consequentemente não provocando calor — assim, não há transformação de calor em trabalho ou vice-versa, não violando, portanto, a segunda lei da termodinâmica, qualquer que seja o sentido de giro do satélite.
R- B
46- Observe as figuras e as explicações abaixo — o primeiro tempo refere-se à admissão, a mistura entra e o gás se expande
isobáricamemte (trecho OA) — o segundo tempo refere-se à compressão (trecho AD) — o terceiro tempo refere-se à combustão, cujo início ocorre devido à faísca elétrica (trecho DC) — o quarto tempo refere-se à exaustão (escape) ao final da qual os gases são expelidos (trecho CB) — a faísca ocorre no início do trecho DC, em C e a liberação dos gases no final do trecho CB, em B — R- D
47- I- Falsa — máquinas térmicas – qualquer dispositivo capaz de transformar a energia interna de um combustível em energia mecânica — também pode ser definida como o dispositivo capaz de transformar parte de calor em trabalho.
II. Correta — enunciado de Clausius — não é possível um processo cujo único resultado seja a transferência de calor de um corpo de menor temperatura a outro de maior temperatura — para que isso ocorra é preciso realizar trabalho — as máquinas frigoríficas não contrariam o enunciado da segunda lei da Termodinâmica, que a referida passagem não é espontânea, ocorrendo à custa de um trabalho externo. No refrigerador das geladeiras comuns existe um líquido refrigerante (freon, tetrafluoretano, etc,), que, ao sofrer expansão passa do estado líquido ao estado gasoso, que abaixa a temperatura na serpentina interna (congelador).
III. Falsa — contraria o segundo princípio da termodinâmica que pode ser definido como: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho”.
IV- Correta — Ciclo de Carnot é o ciclo executado pela máquina de Carnot, idealizada pelo engenheiro francês Carnot e que tem funcionamento apenas teórico — funcionando entre duas transformações isotérmicas e duas adiabáticas alternadamente, permite menor perda de energia (Calor) para o meio externo (fonte fria) — o rendimento da Máquina de Carnot é o máximo que uma máquina térmica trabalhando entre dadas temperaturas da fonte quente e da fonte fria pode ter (mas o rendimento nunca chega a 100%).
R- D
48- Pode-se definir o Segundo Princípio da Termodinâmica da seguinte maneira: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho” — sempre haverá energia dissipada pelo motor — R- C.