Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
Energia interna de um gás perfeito
A energia interna (U) de um gás perfeito monoatômico corresponde à soma das energias cinéticas médias (Ec) de todas as suas moléculas e, pela lei de Joule é fornecida por:
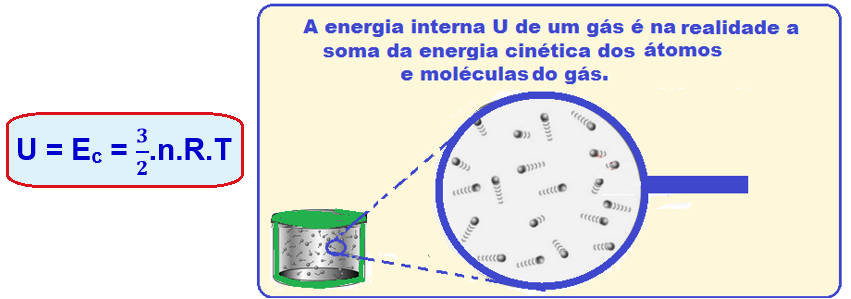
A energia interna de uma certa massa de um gás perfeito é função exclusiva da temperatura desse gás
A afirmação acima indica que a temperatura de um gás é a medida da energia cinética média de suas moléculas.
Observe nas figuras abaixo que quanto maior a temperatura maior é o movimento vibratório das
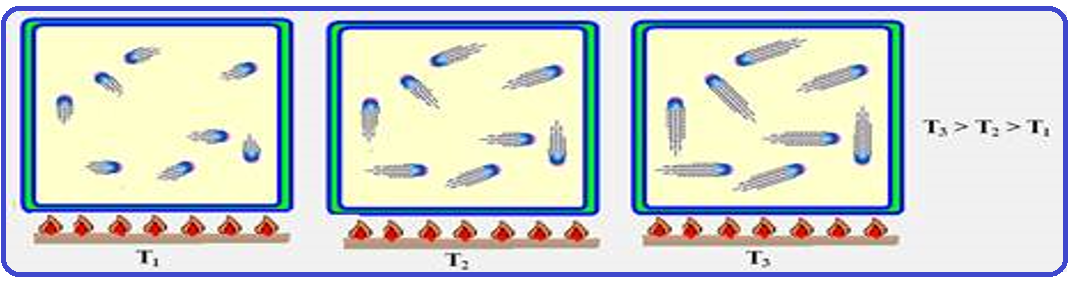
moléculas do gás e consequentemente maior a energia cinética (Ec) de suas moléculas, o que
![]()
Como consequência da expressão acima, você deve observar que:
![]() Aumento de temperatura
Aumento de temperatura ![]() (ΔT > 0)
(ΔT > 0) ![]() aumento de energia interna
aumento de energia interna ![]() (ΔU > 0).
(ΔU > 0).
![]() Diminuição de temperatura
Diminuição de temperatura ![]() (ΔT < 0)
(ΔT < 0) ![]() diminuição de energia interna
diminuição de energia interna ![]() (ΔU<0).
(ΔU<0).
![]() Temperatura constante
Temperatura constante ![]() (ΔT = 0)
(ΔT = 0) ![]() energia interna constante
energia interna constante ![]() (ΔU=0).
(ΔU=0).
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da energia
O Primeiro Princípio da Termodinâmica (Princípio da Conservação da Energia) afirma que: “A energia não pode ser criada nem destruída, mas apenas transformada”
Exemplo numérico:
Suponha que um sistema isolado receba Q = 300J de calor. Se, por exemplo, ΔU = 50J dessa energia forem absorvidos pelo sistema aumentando sua energia interna de 50 J, então a parte restante, W = 250J, será fornecida ao ambiente sob a forma de trabalho.

Então, Q = W + ΔU ou,
Estudo das transformações gasosas baseado no primeiro princípio da termodinâmica
Transformação isotérmica
Como a temperatura (T) e a energia interna (U) de um sistema estão associadas à energia cinética das moléculas, se a temperatura for constante (transformação isotérmica), a energia interna (U) do sistema também será constante.
Assim, a variação de energia interna (ΔU) do sistema será nula.
Transformação isotérmica ![]() ΔU = 0
ΔU = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() 0 = Q – W
0 = Q – W ![]() Q = W.
Q = W.
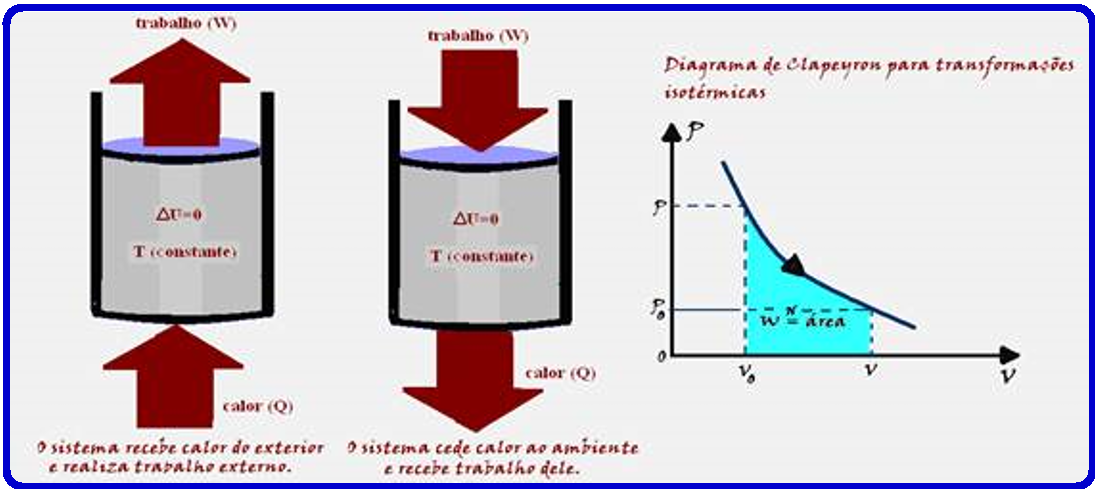
Q = W ![]() Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.
Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.

Transformação isobárica
Ocorre à pressão constante. A variação de temperatura (ΔT) provoca uma variação de energia interna (ΔU) do sistema e a variação de volume (ΔV) produz trabalho.
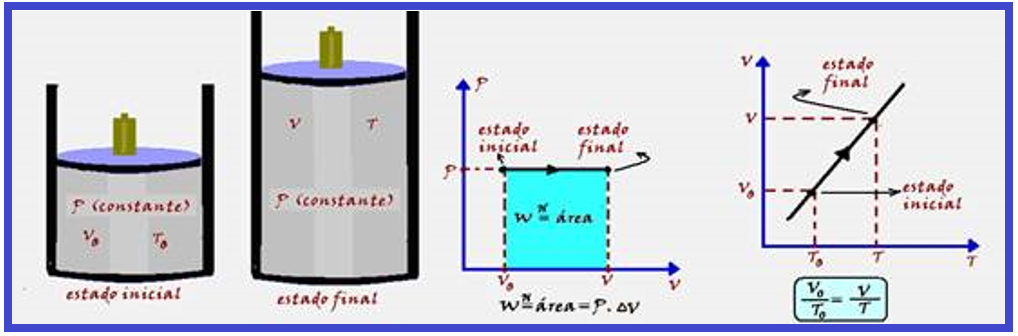
Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W.

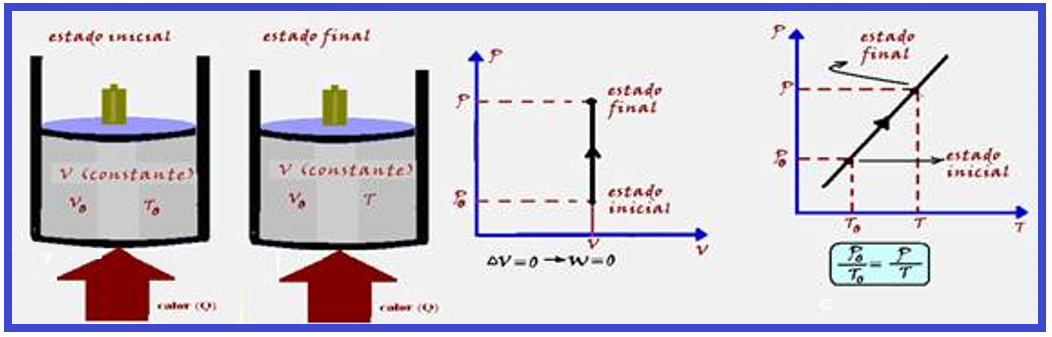
Transformação isocórica, isométrica ou isovolumétrica
Ocorre a volume constante ![]() Vo = V
Vo = V ![]() ΔV = 0
ΔV = 0 ![]() W = P.ΔV
W = P.ΔV ![]() W = P.0
W = P.0 ![]() W = 0
W = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = Q – 0
ΔU = Q – 0 ![]() ΔU = Q
ΔU = Q

Transformação adiabática
Nela, o sistema não troca calor com o meio externo (Q = 0) e isso ocorre porque o gás está termicamente isolado ou porque a transformação é muito rápida de modo que qualquer troca de calor com possa ser considerada.
Se Q = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = 0 – W
ΔU = 0 – W ![]() ΔU = – W.
ΔU = – W.

Leia atentamente as informações a seguir oas aplicações práticas de algumas transformações adiabáticas:
Na figura da esquerda abaixo, ao levantar o pistão da bomba de bicicleta, você diminui a pressão interna o que faz abrir uma válvula localizada abaixo do pistão, fazendo o ar externo penetrar no cilindro.
Ao empurrar o pistão para baixo o aumento de pressão interna fecha automaticamente a válvula de entrada e abre a válvula de saída ligada ao pneu forçando o ar a penetrar no mesmo. Ao levantar o pistão novamente você começa tudo novamente.
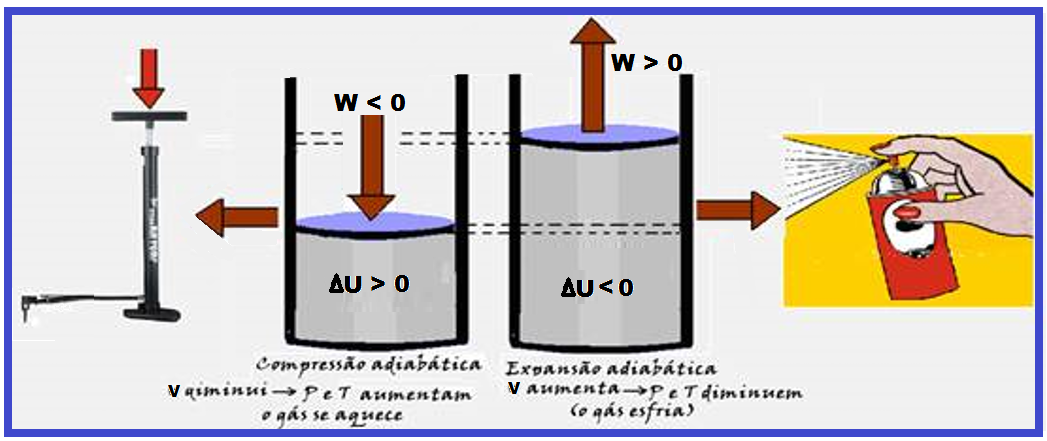
Observe que, cada vez que você bombeia o ar no pneu, a bomba se aquece mais, o que ocorre principalmente porque você está forçando as moléculas de ar ficar mais próximas umas das outras, fazendo com que esse trabalho de compressão do gás (negativo) aumente a energia interna (ΔU), aumentando consequentemente a temperatura do gás.
Isso ocorre porque essa transformação é adiabática (não troca calor com o ambiente, pois é muito rápida) e obedece à função ΔU= – W.
Na figura da direita (acima), trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio ambiente), onde Q = 0 e ΔU = Q – W ![]() ΔU = 0 – W
ΔU = 0 – W ![]() ΔU = – W
ΔU = – W ![]() o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão, e o gás resfria.
o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão, e o gás resfria.
Transformação cíclica
Consiste numa série de transformações gasosas na qual o estado inicial coincide com o estado final, com o gás retornando à mesma pressão, volume e temperatura iniciais.
Toda transformação cíclica deve obedecer às seguintes condições:
![]() Como as temperaturas final e inicial são coincidentes (Ti = Tf), a variação de energia interna (ΔU) é nula
Como as temperaturas final e inicial são coincidentes (Ti = Tf), a variação de energia interna (ΔU) é nula ![]() ΔU = 0.
ΔU = 0.
![]() ΔU = Q – W
ΔU = Q – W ![]() 0 = Q – W
0 = Q – W ![]() Qciclo = Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
Qciclo = Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
![]() Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
Se o ciclo é realizado no sentido horário, o trabalho é positivo.
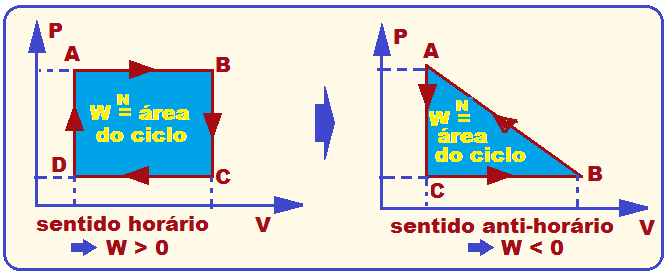
![]() Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
O que você deve saber, informações e dicas
![]()
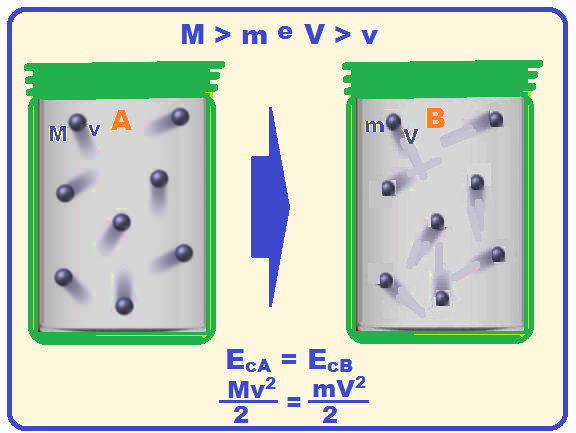
Se a temperatura é a mesma para gases diferentes, a energia cinética das moléculas deve ser a mesma, independente da massa de cada gás.
Como Ec =mV2/2 e a energia cinética é a mesma o gás de maior massa deve ter menor velocidade para que essas energias se igualem.
![]()

A pressão exercida por um gás é o resultado das colisões das moléculas do gás contra as paredes do recipiente e com a freqüência e a intensidade das colisões entre elas mesmas.

![]()
Os gases ideais não existem, pois são apenas modelos teóricos em que o volume das moléculas e suas interações são considerados desprezíveis.
![]()
O Primeiro Princípio da Termodinâmica (Princípio da Conservação da Energia) afirma que: “A energia não pode ser criada nem destruída, mas apenas transformada”
![]()

![]()

![]()

![]()

Leia na teoria, procurando memorizar as aplicações práticas sobre transformações adiabáticas.
![]()
Toda transformação cíclica deve obedecer às seguintes condições:
![]() Como as temperaturas final e inicial são coincidentes (Ti = Tf), a variação de energia interna (ΔU) é nula
Como as temperaturas final e inicial são coincidentes (Ti = Tf), a variação de energia interna (ΔU) é nula ![]() ΔU = 0.
ΔU = 0.
![]() ΔU = Q – W
ΔU = Q – W ![]() 0 = Q – W
0 = Q – W ![]() Qciclo = Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
Qciclo = Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
![]() Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
![]() Se o ciclo é realizado no sentido horário, o trabalho é positivo.
Se o ciclo é realizado no sentido horário, o trabalho é positivo.

![]() Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
![]()
Cotidianamente são usados recipientes de barro (potes, quartinhas, filtros etc.) para esfriar um pouco a água neles contida.
Considere um sistema constituído por uma quartinha cheia d’água.
Parte da água que chega à superfície externa da quartinha, através de seus poros, evapora, retirando calor do barro e da água que o permeia.
Isso implica que também a temperatura da água que está em seu interior diminui nesse processo.
Tal processo se explica porque, na água que evapora, são as moléculas de água com maior energia cinética média que escapam do líquido, diminuindo, assim, a energia cinética média (relacionada à temperatura) desse sistema.
Assim, quanto maior a velocidade de agitação das moléculas, elas escaparão com maior facilidade.
![]()
Durante a compressão de um sistema gasoso, sob a ação de uma força constante, o trabalho

realizado sobre o gás é negativo, pois, se a força é constante a pressão será também constante (isobárica), com W=P.(V2 – V1).
Como o gás está sendo comprimido ![]() V2 < V1
V2 < V1 ![]() W < 0.
W < 0.
![]()

![]()
Mantendo uma estreita abertura em sua boca, assopre com vigor sua mão agora! Viu? Você produziu uma transformação adiabática! Nela, o ar que você expeliu sofreu uma violenta expansão, durante a qual o trabalho realizado correspondeu à diminuição da energia interna desse ar (diminuindo sua temperatura), por não ocorrer troca de calor com o meio externo.
Portanto, trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio ambiente), onde Q = 0 e ΔU= Q – W ![]() ΔU= 0 – W
ΔU= 0 – W ![]() ΔU = – W
ΔU = – W ![]() o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura
o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura ![]() o gás resfria.
o gás resfria.
