Mudanças de estado físico da matéria
Resolução comentada dos exercícios de vestibulares sobre
Mudanças de estado físico da matéria
01- R- A — veja teoria
02- R- E — veja teoria
03- R- B
04- Ele recebe calor que é utilizado apenas para fazer com que ele mude de estado e sua temperatura permaneça constante —
R- C
05- Quanto maior a pressão, maior a temperatura de ebulição — R- B
06- R- D — veja teoria
07- R- B — veja teoria
08- Para se refrescar uma bebida costuma-se colocar nela cubos de gelo a 0oC, em vez de mesma massa de água a 0oC para que o calor necessário para fundir o gelo seja aproveitado para resfriar a bebida — R- A
09- Quanto menor a pressão, menor a temperatura de ebulição — R- E
10- É diretamente proporcional à área da superfície de líquido exposta — R- E
11- Depende da natureza do líquido que está evaporando. Assim, por exemplo, o éter evapora mais rapidamente que a água; é mais volátil que ela. As moléculas do éter, do álcool (ou da gasolina) se atraem umas às outras menos fortemente que as da água, e sua camada superficial é mais fraca. Por isso o éter, álcool (ou a gasolina) se evapora mais ràpidamente — R- E
12- Se diminui o volume, aumenta a pressão sobre o vapor que se condensa mais — R- B
13- Algumas substâncias, como a maior parte dos líquidos e dos metais, aumentam de volume ao se fundir e diminuem de volume ao se solidificar. Outras substâncias (como a água) se comportam de maneira oposta — R- A
14- Ao nível do mar onde a pressão atmosférica é normal e vale 1 atm, em uma panela aberta a água ferve a 100oC. Se essa panela for fechada, o vapor de água que se forma no seu interior, não se dissipa para o ambiente aumentando a pressão interna da panela,
podendo chegar até a 2atm, onde a água ferve a uma temperatura de aproximadamente 120oC.. Nesta pressão a água ferve a uma temperatura aproximadamente igual a 120°C. Assim, os alimentos cozinham em menor tempo. As panelas de pressão possuem válvulas de segurança que funcionam quando a pressão atingir um ponto perigoso — R- B
15- Se determinada massa de água está se vaporizando, sob pressão normal, o fenômeno está ocorrendo a 100oC e, se você
aumentar o tamanho da chama, a temperatura da água continuará sendo de 100oC, apenas a vaporização será mais rápida — R- E
16- À temperatura de -55oC a água em marte estaria no estado sólido — R- E
17- Com a diminuição da pressão (está acima do nível do mar) a temperatura de fusão aumenta e a de vaporização diminui — R- D
18- R- A — veja teoria
19- À medida que a pressão aumenta a temperatura de vaporização da água também aumenta —
R- B
20- R- A — veja teoria
21- Durante toda a fusão a temperatura permanece constante — R- C
22- Quanto maior a pressão, maior será a temperatura de ebulição e vice versa —– R- B
23- R- C — veja teoria
24- 01. Falsa — a temperatura está relacionada com o movimento vibratório (energia cinética) das moléculas.
02. Falsa — durante a fusão e a ebulição a temperatura permanece constante.
04. Falsa — ocorre com líquidos e sólidos
08. Correta — calor é energia em trânsito de um corpo para outro em função da diferença de temperatura entre eles.
16. Correta — o calor é uma onda eletromagnética (raios infravermelhos) que se propagam a partir do Sol, pelo vácuo
R- (8 + 16) = 24
25- A densidade do gelo é menor que a densidade da água ou seja, o gelo ocupa mais espaço do que a quantidade de água equivalente.
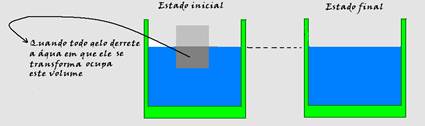
Assim, o volume de água proveniente do gelo derretido é igual ao volume de gelo que estava imerso. Portanto, o nível da água no balde não se altera — R- E
Observação: Baseado nisso, observe que o derretimento de um ice-berg não altera o nível do mar. Existe muito gelo sobre as montanhas. E muito mais gelo sobre continente no Pólo Sul. É justamente este gelo que, ao derreter, escorre para o mar e contribui para o aumento do nível de água.
26- R- A — veja teoria
27- I. Correta — o éter ao se evaporar retira energia (calor) do local machucado.
II. Correta — a evaporação independe da temperatura, mas ela é maior quanto maior for a temperatura.
III. Falsa — quanto mais éter, maior a evaporação e maior será a redução de temperatura do local machucado.
R- D
28- Maior altura, menor pressão e menor temperatura de vaporização — R- C
29- Uma das razões que faz a água, próxima à superfície livre de alguns lagos, congelar no inverno, em regiões de baixas temperaturas, é o fato de que ao ser resfriada, no intervalo aproximado de 4 °C a 0 °C, ela sofre um processo de dilatação.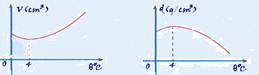
Com isso seu volume aumenta e sua densidade diminui. A água da superfície, mais fria e mais dessa, desce (correntes descendentes) e a água das profundezas, mais quente e menos densa sobe (correntes ascendentes).
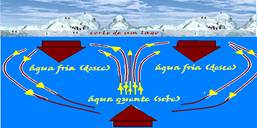
Essas correntes de convecção continuam seu movimento até toda água atingir a temperatura de 4oC (densidade máxima) quando cessam, porque toda água agora tem a mesma densidade.
Mas, se a temperatura da superfície continua diminuindo até abaixo de 0oC, a água da superfície se congela e esse gelo isola por condução o ambiente acima da superfície da água (a menos de 0oC) das águas abaixo da mesma que estão (a 4oC).
Devido a esse fenômeno é possível a vida nas profundezas de lagos e mares, mesmo estando coberta de gelo a sua superfície.
R- D
30- I. Correta — II. Correta — III. Correta — IV. Falsa
R- (01 + 02 + 08)=11
31- Maior altitude, menor temperatura de ebulição — R- D
32- R-E — veja teoria
33- R- B — veja teoria
34- O calor latente de vaporização da água é a quantidade de energia necessária para que uma quantidade de massa unitária (1 grama, 1 quilograma, 1 libra etc.) passe do estado líquido para o gasoso, não interessando em que temperatura o fenômeno ocorre — R- C
35- a) Não ocorre ascensão de ar frio, pois este é mais denso. O que pode ocorrer é a ascensão de ar quente, por ser menos denso.
b) A sublimação envolve os estados gasoso e sólido. Está claro pelo texto que as gotas sofrem congelamento (solidificação).
c) As gotas não sofrem evaporação e sim solidificação.
d) O granizo é sólido e logo não sofre vaporização.
e)Para que o granizo precipite é necessário que a resultante ocorra em sentido à terra.
R- E
36- R- C — veja teoria
37– R- D
38- R- D — veja teoria
39- R- B — veja teoria
40- Sublimação é a passagem sólido-vapor, que corresponde ao trecho HT (veja figura abaixo)
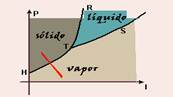
R- C
41– a) Pela tabela, quando a pressão é de 880mmHg, a temperatura de ebulição da água é de 105oC — no gráfico, quando T=105oC, o tempo de cozimento é de 20 minutos.
b) Se, para cada 100m de altitude a pressão diminui de 10 mmHg, na altitude de 800m, ela sofrerá uma diminuição de 80 mmHg — então, em Gramado (800m de altitude) a pressão atmosférica será — P=760 – 80=680mmHg — para essa pressão a tabela nos fornece a temperatura de 97oC, que, no gráfico, nos fornece o tempo correspondente — t=60 minutos
c) Ao nível do mar a pressão é de 760 mmHg e a temperatura de ebulição da água é de 100°C — no gráfico, para a temperatura de 100°C temos um tempo de cozimento de 40 min — para o tempo de cozimento de 80 min, a temperatura de fervura será de 95ºC, de acordo com o gráfico — verificando na tabela, a temperatura de 95°C corresponde á pressão de 640 mmHg — a diferença de pressão será — P=760 – 640=120mmHg — a altitude correspondente será de 1.200m.
42- R- A — veja teoria
43- A água permanece em estado líquido, está em ebulição e o vapor é liberado para o ambiente pela válvula, a pressão e a temperatura aumentam (TA<TB e PA<PB) — R- D
44- Havendo mudança na fase da água, sem a ocorrência da fase líquida, concluí-se que ocorre sublimação, o que valida a afirmação I.
A sublimação só pode ocorrer em pressão inferior à pressão do ponto triplo, o que valida a afirmação II.
A afirmação III estabelece uma relação direta entre fusão e ponto triplo o que a invalida.
R- D
45-
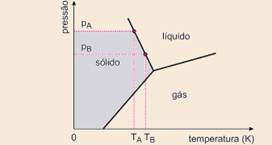
De imediato eliminamos as opções a) e b), pois a baixas temperaturas a água está na fase
gasosa — a opção c) apresenta aumento de temperatura de fusão com o aumento de pressão — abaixo mostramos a coerência da opção d) com o enunciado — pA > pB — TA < TB
R- D
46- a) A temperatura de ebulição de uma substância depende da própria substância e da pressão. Por isso que se usa a panela de pressão. Aumenta-se a pressão na superfície da água aumentando a dificuldade de as moléculas vaporizarem, aumentando, portanto, a temperatura de ebulição.
No caso dessa questão, ao se jogar água fria na tampa da jarra, diminui-se a pressão na superfície do líquido, diminuindo a temperatura de ebulição.
b) Aumentando a altitude, diminui-se a pressão, diminuindo a temperatura de ebulição da água. Somente para exemplificar: em São Paulo a água ferve a 98 °C, em Brasília, a 96 °C e, em La Paz, a 87 °C.
47- A temperatura de mudança de fase de uma substância pura e cristalina depende exclusivamente da pressão. No caso da água, a temperatura de vaporização é 100 °C. Atingida essa temperatura, todo calor absorvido é usado para mudança de fase. Se colocarmos a água numa panela de pressão ele irá ferver a uma temperatura constante maior que 100 °C, dependendo da pressão interna da panela — R- C
48- As quantidades de calor sensível liberadas por cada uma das bolas são transferidas para os blocos de gelos.
Como o ferro tem maior condutividade térmica que a madeira, ele transfere calor mais rapidamente para o gelo, sofrendo um resfriamento mais rápido. — a quantidade de calor sensível de cada esfera é igual, em módulo, a quantidade de calor latente absorvida por cada bloco de gelo — Q=mcΔθ — Como as massas das bolas são iguais e as variações de temperatura também, a massa de gelo fundida em cada caso é diretamente proporcional ao calor específico do material que constitui a bola. Assim, analisando a expressão, vemos que funde menor quantidade de gelo a bola de material de menor calor específico, no caso, a de metal.
R- C
49- Quando você puxa o êmbolo você está aumentando o volume da região onde está a água provocando uma diminuição da pressão e consequentemente a temperatura de ebulição diminui fazendo com que a água ferva a uma temperatura menor que 100oC — R- D
50- Relação entre os calores específicos molares — Cp – CV=R — Cp – 3R=R — Cp=4R — CV=3R — a razão entre esses calores específicos fornece o expoente λ — λ=CV/CP=4R/3R=4/3 — pressão p à 30m de profundidade — P Po + dgh=105 + 103.10.30 — P=105 + 3.105 — P=4.105 N/m2 — numa transformação adiabática de um gás ideal — P.Vλ = Po.Voλ — 4.105.104/3 = 105.Vo4/3 — elevando os dois membros a ¾ — (4.104/3)3/4 = (Vo4/3)3/4 — 43/4.101 = Vo — Vo=10 .4√43=10.4√(24.22) — Vo=20.4√22 — Vo≈28,3 cm
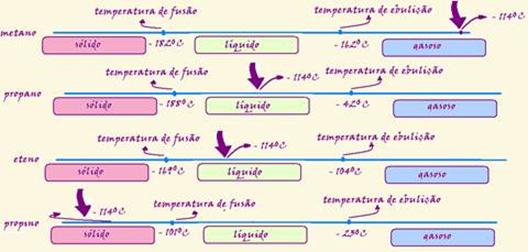
51- R- E — veja esquema abaixo
Voltar para os exercícios
