Mudanças de estado físico da matéria
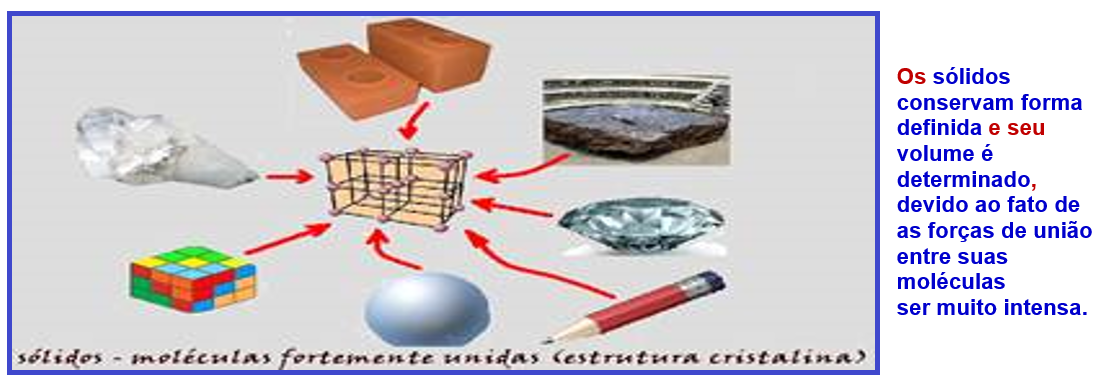
Características moleculares dos sólidos
Características moleculares dos líquidos
Características moleculares dos gases
Os gases não possuem forma própria e seu volume é variável, já que suas moléculas se deslocam em todas as direções e sentidos.
Observe pelo que foi fornecido acima que, se você quiser fazer com que um corpo mude de estado físico passando de sólido para líquido e depois para gasoso (tem que ser nessa ordem), ele deve receber calor, para aumentar o movimento vibratório de suas moléculas aumentando assim sua temperatura.
Do mesmo modo, a passagem gasoso, líquido e sólido (nessa ordem), só pode ocorrer se o corpo perder calor (diminuir sua temperatura).
Mudanças de estado físico
Temperatura na fusão e na solidificação
Nem sempre que um corpo recebe calor, sua temperatura aumenta.
Assim, por exemplo, aquecendo-se gelo a 0oC sob pressão normal e mexendo cuidadosamente a mistura até a fusão total do gelo, você não observa aumento de temperatura do conteúdo, que
permanece durante toda a transformação sempre com a temperatura de 0oC.
Características da fusão
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
Graficamente:
Comportamento das substâncias na fusão e na solidificação
Outras substâncias (como a água) se comportam de maneira oposta.
Gráfico da variação da pressão em função da temperatura de
fusão-solidificação para algumas substâncias e para a água
A temperatura de fusão ou de solidificação varia com a pressão.
Observe os gráficos abaixo e veja que, no caso da água (gráfico da direita) um aumento de pressão
provoca uma diminuição de sua temperatura de fusão-solidificação e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas, fenômeno denominado regelo.
Regelo
Fenômeno pelo qual um aumento de pressão provoca uma diminuição da temperatura de fusão-solidificação da água e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas.
Fenômenos que se pode explicar pelo regelo
temperatura de fusão do gelo diminua e o gelo abaixo do fio derreta.
Com o derretimento, o fio afunda lentamente e a água acima do mesmo volta a congelar, pois já não existe mais a pressão do fio.
Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.
Características da vaporização e condensação (liquefação)
constante, denominada temperatura de vaporização (àquela pressão).
Gráfico da variação da pressão em função da temperatura de
condensação-vaporização para algumas substâncias e para a água
A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão (veja gráfico) que mostra que, quando a pressão aumenta, a temperatura de vaporização também aumenta e se a pressão diminui, a temperatura de vaporização também diminui.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.
Tipos de vaporização
I. Evaporação: processo de vaporização que ocorre num grande intervalo de tempo, que se processa lenta e espontaneamente, independente da temperatura, e só acontece na superfície do líquido.
Ocorre com a superfície do líquido exposta ao meio ambiente de onde ele retira calor para se evaporar. Pode também retirar calor do meio com o qual está em contato. Veja casos nas figuras fornecidas:
Rapidez da evaporação
A rapidez com que a evaporação ocorre:
vapor evaporadas, dificultando sua saída da superfície líquida.
Portanto, a evaporação é mais rápida no alto da serra e mais lenta ao nível do mar.
As moléculas do éter, do álcool (ou da gasolina) se atraem umas às outras menos fortemente que as da água, e sua camada superficial é mais fraca.
Por isso o éter, álcool (ou a gasolina) se evapora mais rapidamente que a água.
Depende da temperatura da substância que está evaporando.
Isso ocorre porque quanto maior a temperatura, maior é o movimento vibratório das moléculas do líquido, tendo assim, mais facilidade para escaparem da superfície líquida.
É diretamente proporcional à área da superfície de líquido exposta.
II. Ebulição: processo rápido e violento de vaporização, que envolve todo o líquido com formação de bolhas no seu interior.
Exemplo: água fervendo.
III. Calefação: ocorre quando se coloca um líquido em contato com uma superfície de temperatura maior que a de ebulição do líquido.
Nesse processo o líquido gira rapidamente, adquire forma esférica, divide-se em esferas menores que se movem rápida e desordenadamente, emitindo um som característico.
O líquido não entra em contato com a superfície aquecida.
Isso ocorre porque quando a camada inferior da gota evapora, as moléculas de água gasosa da camada não têm para onde escapar, assim que sua presença isola o resto da gota e impede que esta toque a superfície quente abaixo.
A gota, assim, permanece por alguns segundos, sem evaporar.
Diagrama de estado – ponto triplo
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases. Nele, para uma dada substância:
Temperatura Crítica
Thomas Andrews estabeleceu que: “Temperatura crítica é aquela acima da qual uma massa gasosa não pode mais sofrer liquefação, por maior que seja a pressão exercida”.
À pressão na qual a temperatura é crítica dá-se o nome de pressão crítica.
Veja, abaixo, um exemplo da aplicação do diagrama de fases:
Baseado no diagrama de fases você pode, por exemplo, efetuar a liquefação do vapor que se encontra no estado A por três processos:
Resfriá- lo sob pressão constante até atingir o estado líquido (trajeto AD) ou,
comprimi-lo à temperatura constante (trajeto AB) ou ainda resfriá-lo e comprimi-lo simultaneamente (trajeto AC)
O que você deve saber, informações e dicas
Mudanças de estado físico
A temperatura permanece constante durante tora mudança de estado, desde que a pressão permaneça constante.
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
Um pedaço de gelo flutua em equilíbrio térmico com certa quantidade de água depositada em um balde.
À medida que o gelo derrete o nível da água no balde não se altera.
A densidade do gelo é menor que a densidade da água ou seja, o gelo ocupa mais espaço do que a quantidade de água equivalente.
Assim, o volume de água proveniente do gelo derretido é igual ao volume de gelo que estava imerso. Por esse motivo, o nível da água no balde não se altera.
Observação: Baseado nisso, observe que o derretimento de um iceberg (que fica flutuando parcialmente imerso na água) não altera o nível do mar.
Mas, existe muito gelo sobre as montanhas e muito mais gelo sobre o continente do Polo Sul. É justamente este gelo que, ao derreter, escorre para o mar e contribui para o aumento do nível de água.
É possível comprovar esse fenômeno fisicamente: Como o gelo e a água se encontram em equilíbrio térmico, a temperatura de ambos é igual a 0ºC.
Sendo mG a massa de gelo, Vi o volume de gelo imerso e da a densidade da água, temos no equilíbrio de forças para o gelo flutuando que o empuxo E (vertical e para cima) deve ser igual ao peso P (vertical e para baixo).
P = E
Quando o gelo derrete, ocupará um volume VA, e lembrando que mgelo = mágua
Substituindo (II) em (I)
Ou seja, o volume de água proveniente do gelo derretido (Va) é igual ao volume de gelo que estava imerso (Vi). Portanto, o nível da água no balde não se altera.
O diagrama abaixo representa a temperatura de uma substância inicialmente sólida em função do tempo, recebendo calor de uma fonte, sob pressão constante.
Observe que: no trecho AB ela se encontra no estado sólido; no trecho BC ela está mudando de estado e sua temperatura de fusão-solidificação é de 0oC; no trecho CD ela está no estado líquido; no trecho DE ela está mudando de estado e sua temperatura de vaporização-condensação é de 60oC e no trecho EF ela está no estado gasoso.
Observe também que não é a água, pois se vaporiza ou condensa a 60oC e não a 100oC.
Regelo
Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.
Veja na teoria alguns dos importantes fenômenos que podem ser explicados pelo regelo.
A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão.
Se determinada massa de água está se vaporizando, sob pressão normal, o fenômeno está ocorrendo a 100oC e, se você aumentar o tamanho da chama, a temperatura da água continuará sendo de 100oC, apenas a vaporização será mais rápida.
Ao nível do mar, a água ferve a 100oC. No alto de uma montanha, onde a pressão é menor, a água ferve a uma temperatura menor que 100oC.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.
Fraturas hidrotérmicas estão se abrindo no fundo do mar através das quais água muito quente é descarregada nos oceanos.
A água que emerge dessas fraturas a uma profundidade de 2400 m possui uma temperatura de 552 K.
Apesar dessa temperatura, a água não entra em ebulição por causa da alta pressão no fundo do oceano, pois, a medida que a pressão aumenta a temperatura de vaporização da água também aumenta.
A água pode ferver sem necessidade de aquecimento quando num recipiente aberto, no vácuo (pressão nula) ou em grandes altitudes, 27km, onde a pressão é muito baixa.
Nos dias frios, quando uma pessoa expele ar pela boca, forma-se uma espécie de “fumaça” junto ao rosto.
Isso ocorre porque a pessoa expele ar quente e úmido que se esfria, ocorrendo a condensação dos vapores expelidos.
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases.
Nele, para uma dada substância:
Neste gráfico, o ponto C, comum às três curvas recebe o nome de ponto tríplice e, nele, a substância encontra-se em equilíbrio nos três estados: sólido, líquido e vapor.