Mudanças de estado físico da matéria
Mudanças de estado físico da matéria
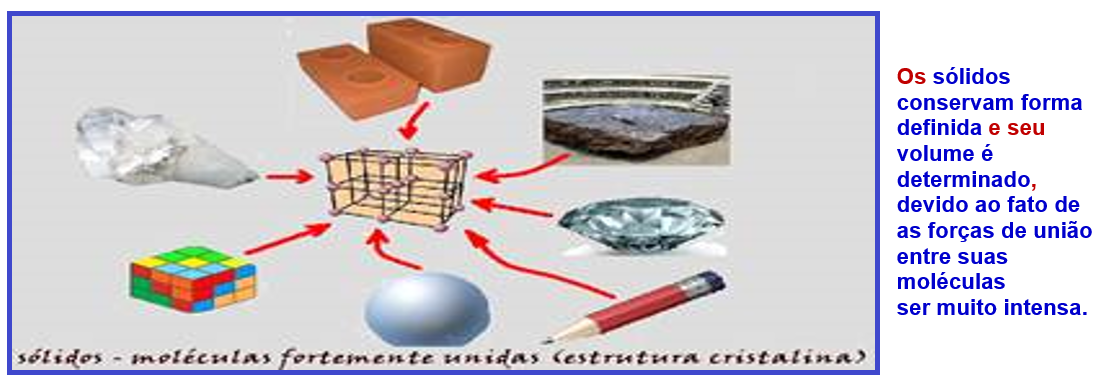
Características moleculares dos sólidos
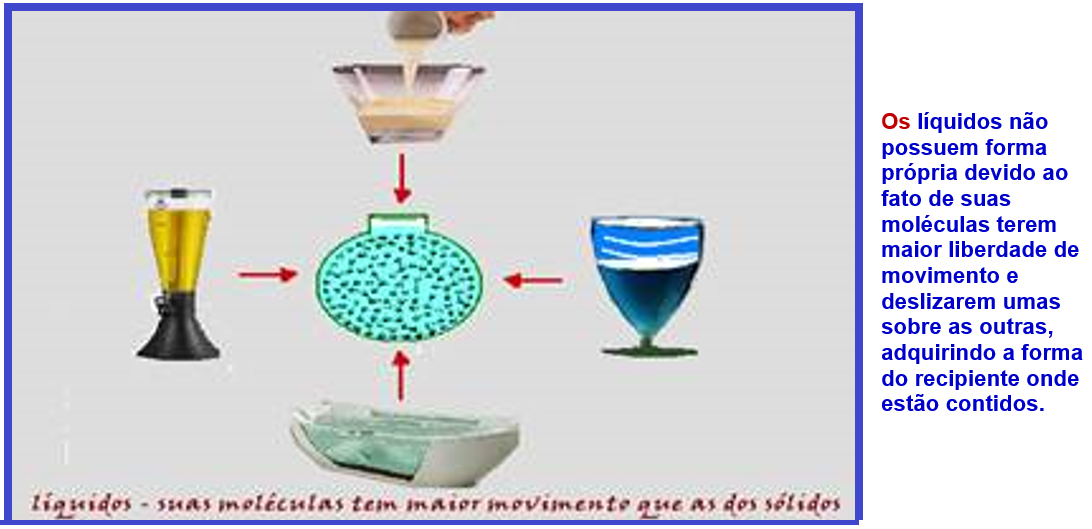
Características moleculares dos líquidos
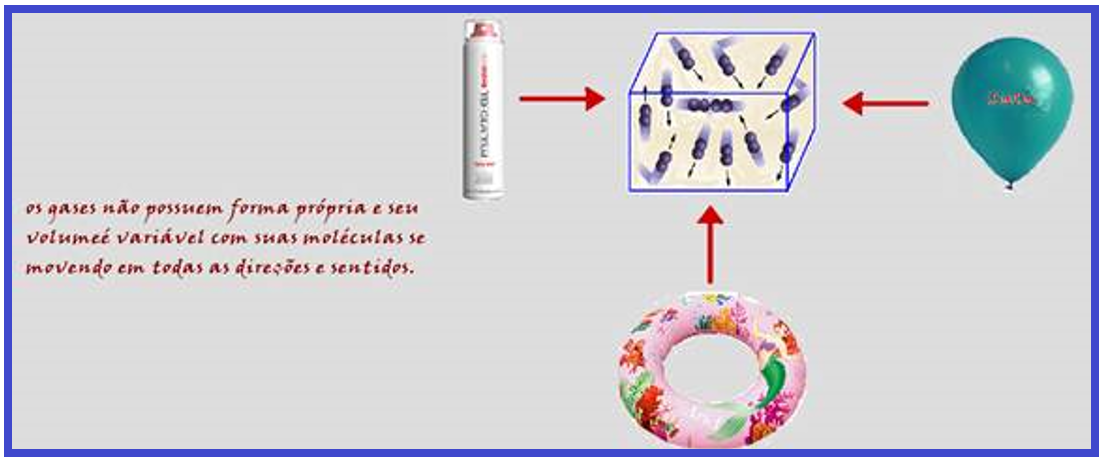
Características moleculares dos gases
Os gases não possuem forma própria e seu volume é variável, já que suas moléculas se deslocam em todas as direções e sentidos.
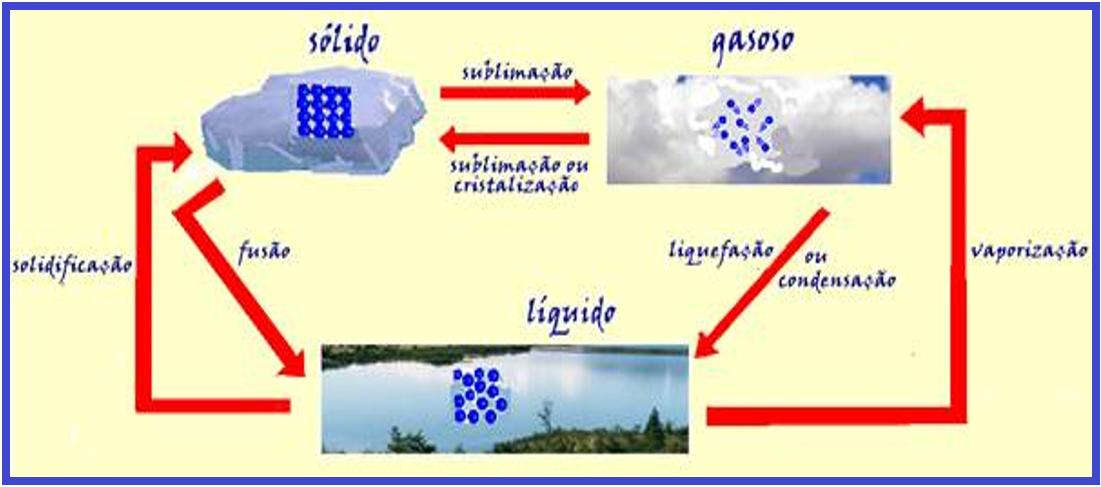
Observe pelo que foi fornecido acima que, se você quiser fazer com que um corpo mude de estado físico passando de sólido para líquido e depois para gasoso (tem que ser nessa ordem), ele deve receber calor, para aumentar o movimento vibratório de suas moléculas aumentando assim sua temperatura.
Do mesmo modo, a passagem gasoso, líquido e sólido (nessa ordem), só pode ocorrer se o corpo perder calor (diminuir sua temperatura).
Mudanças de estado físico
Temperatura na fusão e na solidificação
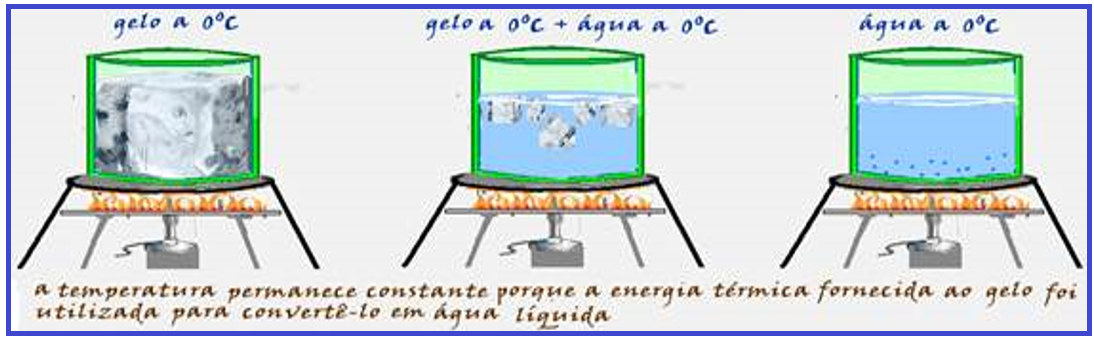
Nem sempre que um corpo recebe calor, sua temperatura aumenta.
Assim, por exemplo, aquecendo-se gelo a 0oC sob pressão normal e mexendo cuidadosamente a mistura até a fusão total do gelo, você não observa aumento de temperatura do conteúdo, que
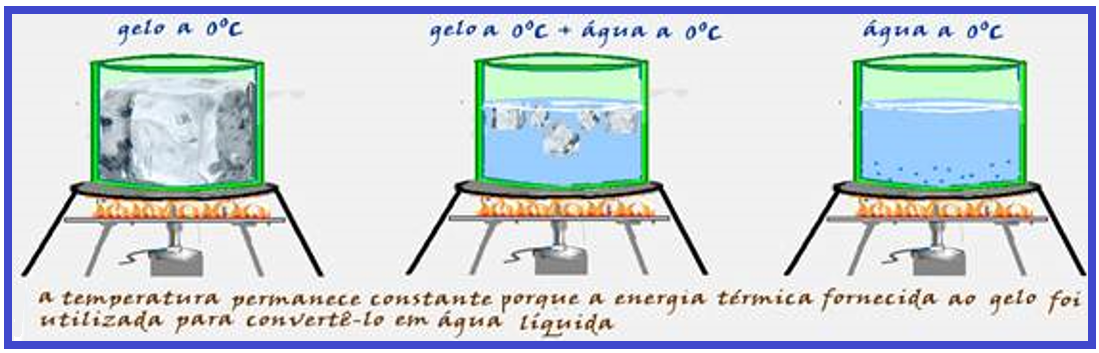
permanece durante toda a transformação sempre com a temperatura de 0oC.
Características da fusão
![]() Toda substância, sob determinada pressão, sofre fusão (passagem de sólido para líquido) a uma dada temperatura, correspondente à pressão considerada, e que se denomina temperatura de fusão da substância e que ocorre quando a substância recebe calor.
Toda substância, sob determinada pressão, sofre fusão (passagem de sólido para líquido) a uma dada temperatura, correspondente à pressão considerada, e que se denomina temperatura de fusão da substância e que ocorre quando a substância recebe calor.
 A temperatura permanecerá constante durante toda a mudança de estado, desde que a pressão permaneça constante.
A temperatura permanecerá constante durante toda a mudança de estado, desde que a pressão permaneça constante.
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
![]() Se você tiver, por exemplo, um pedaço de gelo a -20oC recebendo calor sob pressão normal, você observa que:
Se você tiver, por exemplo, um pedaço de gelo a -20oC recebendo calor sob pressão normal, você observa que:
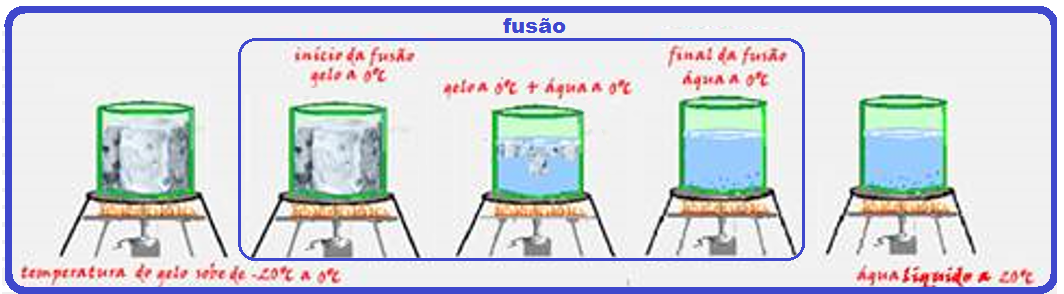
Graficamente:

Comportamento das substâncias na fusão e na solidificação
![]() Algumas substâncias, como a maior parte dos líquidos e dos metais, aumentam de volume ao se fundir e diminuem de volume ao se solidificar.
Algumas substâncias, como a maior parte dos líquidos e dos metais, aumentam de volume ao se fundir e diminuem de volume ao se solidificar.
Outras substâncias (como a água) se comportam de maneira oposta.
![]() Devido ao fato de a água aumentar de volume ao se solidificar, uma garrafa cheia de água, tampada, se quebra quando a água em seu interior se solidifica e um iceberg flutua, pois seu volume aumenta, sua densidade fica menor que a da água, ele fica mais leve que a mesma, flutuando.
Devido ao fato de a água aumentar de volume ao se solidificar, uma garrafa cheia de água, tampada, se quebra quando a água em seu interior se solidifica e um iceberg flutua, pois seu volume aumenta, sua densidade fica menor que a da água, ele fica mais leve que a mesma, flutuando.
Gráfico da variação da pressão em função da temperatura de
fusão-solidificação para algumas substâncias e para a água
A temperatura de fusão ou de solidificação varia com a pressão.
Observe os gráficos abaixo e veja que, no caso da água (gráfico da direita) um aumento de pressão
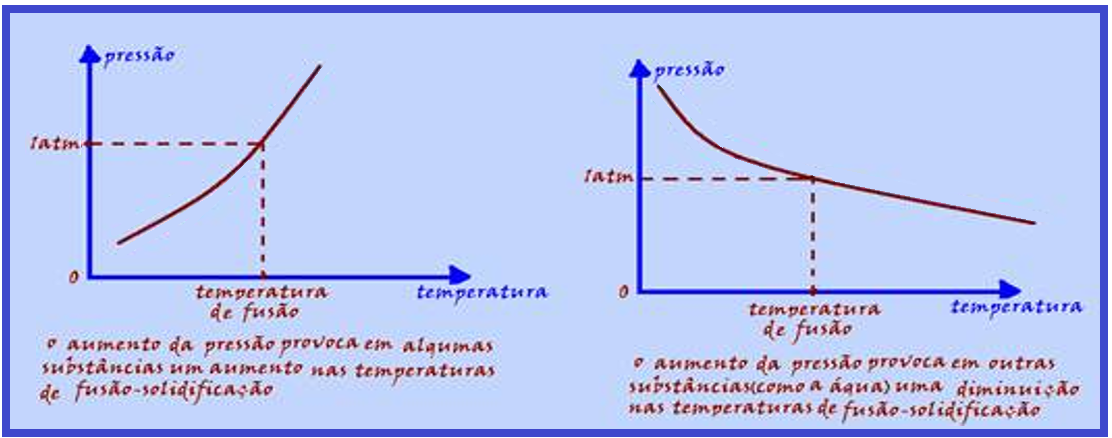
provoca uma diminuição de sua temperatura de fusão-solidificação e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas, fenômeno denominado regelo.
Regelo
Fenômeno pelo qual um aumento de pressão provoca uma diminuição da temperatura de fusão-solidificação da água e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas.
Fenômenos que se pode explicar pelo regelo
![]() Experiência de Tyndall
Experiência de Tyndall ![]() quando você apoia um arame fino com pesos nas extremidades, sobre um bloco de gelo, após certo tempo o arame atravessa o gelo e a barra continua inteira, pois o aumento da pressão provocado pelos pesos faz com que a
quando você apoia um arame fino com pesos nas extremidades, sobre um bloco de gelo, após certo tempo o arame atravessa o gelo e a barra continua inteira, pois o aumento da pressão provocado pelos pesos faz com que a
temperatura de fusão do gelo diminua e o gelo abaixo do fio derreta.
Com o derretimento, o fio afunda lentamente e a água acima do mesmo volta a congelar, pois já não existe mais a pressão do fio.
![]() Ao comprimir fortemente um cubo de gelo contra o outro você verifica que eles ficam “soldados”.
Ao comprimir fortemente um cubo de gelo contra o outro você verifica que eles ficam “soldados”.

Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.


![]()

Características da vaporização e condensação (liquefação)
![]() Mantida a pressão constante, a vaporização (líquido em vapor) ou condensação (vapor em líquido) ocorre à temperatura
Mantida a pressão constante, a vaporização (líquido em vapor) ou condensação (vapor em líquido) ocorre à temperatura
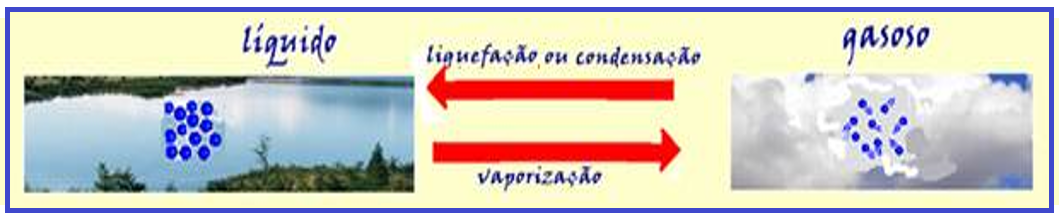
constante, denominada temperatura de vaporização (àquela pressão).
![]()
Gráfico da variação da pressão em função da temperatura de
condensação-vaporização para algumas substâncias e para a água

A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão (veja gráfico) que mostra que, quando a pressão aumenta, a temperatura de vaporização também aumenta e se a pressão diminui, a temperatura de vaporização também diminui.
![]()

![]() Ao nível do mar, a água ferve a 100oC. No alto de uma montanha, onde a pressão atmosférica é menor, a água ferve a uma temperatura
Ao nível do mar, a água ferve a 100oC. No alto de uma montanha, onde a pressão atmosférica é menor, a água ferve a uma temperatura
 menor que 100oC.
menor que 100oC.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.

Tipos de vaporização
I. Evaporação: processo de vaporização que ocorre num grande intervalo de tempo, que se processa lenta e espontaneamente, independente da temperatura, e só acontece na superfície do líquido.
Ocorre com a superfície do líquido exposta ao meio ambiente de onde ele retira calor para se evaporar. Pode também retirar calor do meio com o qual está em contato. Veja casos nas figuras fornecidas:



Rapidez da evaporação
A rapidez com que a evaporação ocorre:
![]() É inversamente proporcional à pressão. Observe nas figuras abaixo que a maior pressão comprime mais as moléculas de
É inversamente proporcional à pressão. Observe nas figuras abaixo que a maior pressão comprime mais as moléculas de
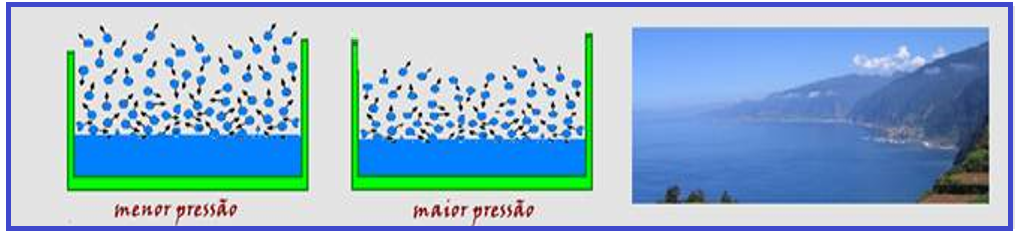
vapor evaporadas, dificultando sua saída da superfície líquida.
Portanto, a evaporação é mais rápida no alto da serra e mais lenta ao nível do mar.
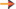 Depende da natureza do líquido que está evaporando. Assim, por exemplo, o éter evapora mais rapidamente que a água; é mais volátil que ela.
Depende da natureza do líquido que está evaporando. Assim, por exemplo, o éter evapora mais rapidamente que a água; é mais volátil que ela.
As moléculas do éter, do álcool (ou da gasolina) se atraem umas às outras menos fortemente que as da água, e sua camada superficial é mais fraca.
Por isso o éter, álcool (ou a gasolina) se evapora mais rapidamente que a água.
![]()
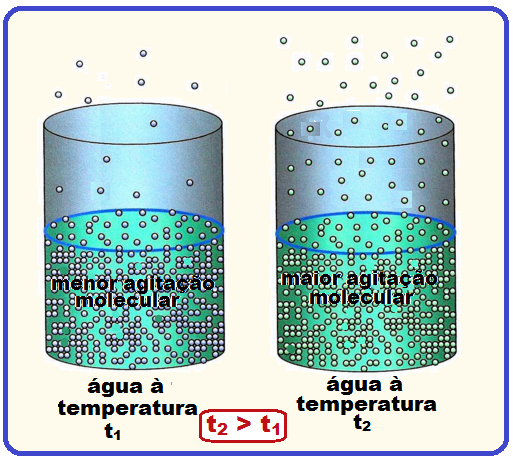
Depende da temperatura da substância que está evaporando.
Isso ocorre porque quanto maior a temperatura, maior é o movimento vibratório das moléculas do líquido, tendo assim, mais facilidade para escaparem da superfície líquida.
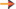

É diretamente proporcional à área da superfície de líquido exposta.
![]() Depende da concentração de vapor de água (umidade do ar), junto ao líquido.
Depende da concentração de vapor de água (umidade do ar), junto ao líquido.
II. Ebulição: processo rápido e violento de vaporização, que envolve todo o líquido com formação de bolhas no seu interior.

Exemplo: água fervendo.
III. Calefação: ocorre quando se coloca um líquido em contato com uma superfície de temperatura maior que a de ebulição do líquido.
Nesse processo o líquido gira rapidamente, adquire forma esférica, divide-se em esferas menores que se movem rápida e desordenadamente, emitindo um som característico. 
O líquido não entra em contato com a superfície aquecida.
Isso ocorre porque quando a camada inferior da gota evapora, as moléculas de água gasosa da camada não têm para onde escapar, assim que sua presença isola o resto da gota e impede que esta toque a superfície quente abaixo.
A gota, assim, permanece por alguns segundos, sem evaporar.
Diagrama de estado – ponto triplo
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases. Nele, para uma dada substância:
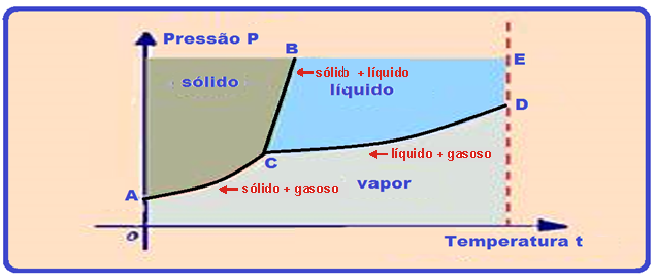
![]() Curva CB
Curva CB ![]() fornece a temperatura e a pressão, de fusão ou solidificação e essa curva representa a curva de fusão onde os estados sólido e líquido estão em equilíbrio ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados sólido e líquido.
fornece a temperatura e a pressão, de fusão ou solidificação e essa curva representa a curva de fusão onde os estados sólido e líquido estão em equilíbrio ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados sólido e líquido.
![]() Curva CD
Curva CD ![]() fornece a temperatura e a pressão, de vaporização ou condensação e essa curva representa a curva de vaporização onde os estados líquido e vapor estão em equilíbrio, ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados vapor e líquido.
fornece a temperatura e a pressão, de vaporização ou condensação e essa curva representa a curva de vaporização onde os estados líquido e vapor estão em equilíbrio, ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados vapor e líquido.
![]() Curva AC
Curva AC ![]() fornece a temperatura e pressão, de sublimação ou cristalização e essa curva representa a curva de sublimação onde os estados sólido e vapor estão em equilíbrio, ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados sólido e vapor.
fornece a temperatura e pressão, de sublimação ou cristalização e essa curva representa a curva de sublimação onde os estados sólido e vapor estão em equilíbrio, ou seja, em qualquer ponto desta curva a substância está em um estado de coexistência de estados sólido e vapor.

Temperatura Crítica
Thomas Andrews estabeleceu que: “Temperatura crítica é aquela acima da qual uma massa gasosa não pode mais sofrer liquefação, por maior que seja a pressão exercida”.
À pressão na qual a temperatura é crítica dá-se o nome de pressão crítica.
Veja, abaixo, um exemplo da aplicação do diagrama de fases:
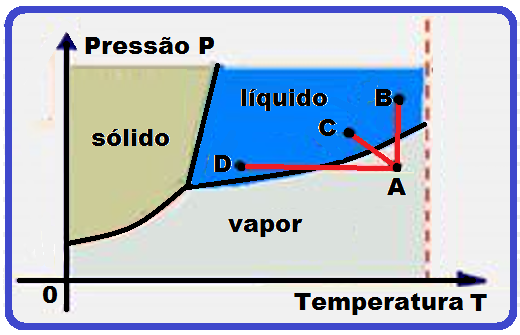
Baseado no diagrama de fases você pode, por exemplo, efetuar a liquefação do vapor que se encontra no estado A por três processos:
Resfriá- lo sob pressão constante até atingir o estado líquido (trajeto AD) ou,
comprimi-lo à temperatura constante (trajeto AB) ou ainda resfriá-lo e comprimi-lo simultaneamente (trajeto AC)
O que você deve saber, informações e dicas
![]()
Mudanças de estado físico

![]()
A temperatura permanece constante durante tora mudança de estado, desde que a pressão permaneça constante.
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
![]()

![]()

Um pedaço de gelo flutua em equilíbrio térmico com certa quantidade de água depositada em um balde.
À medida que o gelo derrete o nível da água no balde não se altera.
A densidade do gelo é menor que a densidade da água ou seja, o gelo ocupa mais espaço do que a quantidade de água equivalente.
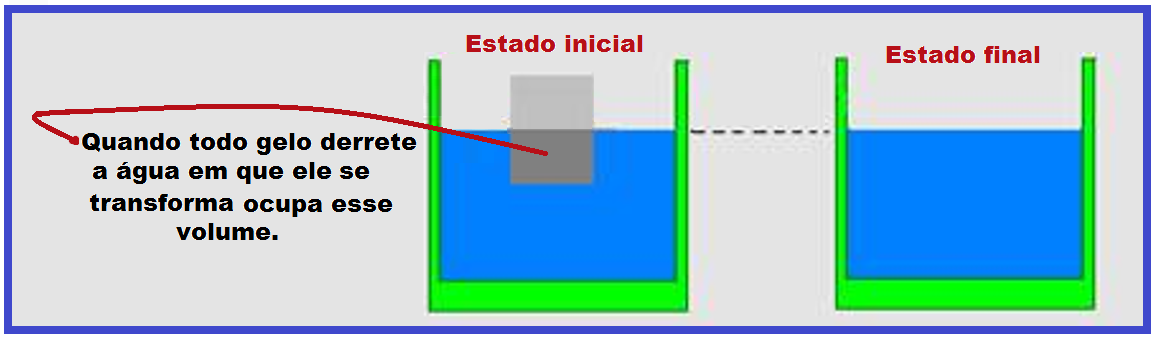
Assim, o volume de água proveniente do gelo derretido é igual ao volume de gelo que estava imerso. Por esse motivo, o nível da água no balde não se altera.
Observação: Baseado nisso, observe que o derretimento de um iceberg (que fica flutuando parcialmente imerso na água) não altera o nível do mar.
Mas, existe muito gelo sobre as montanhas e muito mais gelo sobre o continente do Polo Sul. É justamente este gelo que, ao derreter, escorre para o mar e contribui para o aumento do nível de água.
É possível comprovar esse fenômeno fisicamente: Como o gelo e a água se encontram em equilíbrio térmico, a temperatura de ambos é igual a 0ºC.
Sendo mG a massa de gelo, Vi o volume de gelo imerso e da a densidade da água, temos no equilíbrio de forças para o gelo flutuando que o empuxo E (vertical e para cima) deve ser igual ao peso P (vertical e para baixo).
P = E ![]() mgelo.g = da.g.Vi
mgelo.g = da.g.Vi ![]() Vi = mgelo/da (I).
Vi = mgelo/da (I).
Quando o gelo derrete, ocupará um volume VA, e lembrando que mgelo = mágua ![]() mgelo= da.Va (II)
mgelo= da.Va (II)
Substituindo (II) em (I) ![]() Vi = da.Va /da
Vi = da.Va /da ![]() Vi = Va.
Vi = Va.
Ou seja, o volume de água proveniente do gelo derretido (Va) é igual ao volume de gelo que estava imerso (Vi). Portanto, o nível da água no balde não se altera.
![]()
O diagrama abaixo representa a temperatura de uma substância inicialmente sólida em função do tempo, recebendo calor de uma fonte, sob pressão constante.
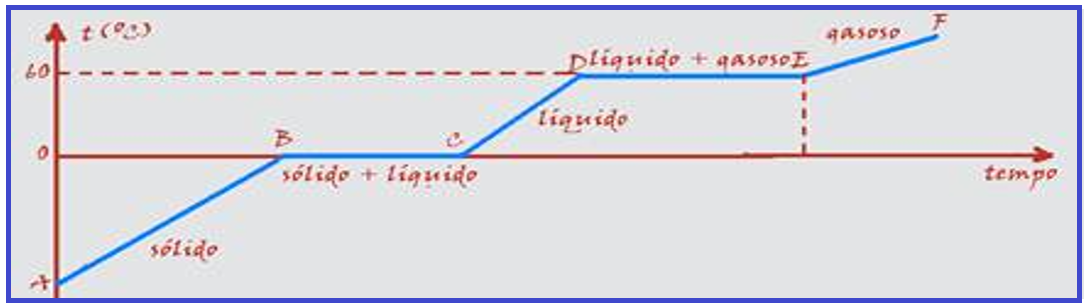
Observe que: no trecho AB ela se encontra no estado sólido; no trecho BC ela está mudando de estado e sua temperatura de fusão-solidificação é de 0oC; no trecho CD ela está no estado líquido; no trecho DE ela está mudando de estado e sua temperatura de vaporização-condensação é de 60oC e no trecho EF ela está no estado gasoso.
Observe também que não é a água, pois se vaporiza ou condensa a 60oC e não a 100oC.
![]()
Regelo
Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.
Veja na teoria alguns dos importantes fenômenos que podem ser explicados pelo regelo.
![]()
A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão.
![]()
Se determinada massa de água está se vaporizando, sob pressão normal, o fenômeno está ocorrendo a 100oC e, se você aumentar o tamanho da chama, a temperatura da água continuará sendo de 100oC, apenas a vaporização será mais rápida.
![]()
Ao nível do mar, a água ferve a 100oC. No alto de uma montanha, onde a pressão é menor, a água ferve a uma temperatura menor que 100oC.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.
![]()
Fraturas hidrotérmicas estão se abrindo no fundo do mar através das quais água muito quente é descarregada nos oceanos.
A água que emerge dessas fraturas a uma profundidade de 2400 m possui uma temperatura de 552 K.

Apesar dessa temperatura, a água não entra em ebulição por causa da alta pressão no fundo do oceano, pois, a medida que a pressão aumenta a temperatura de vaporização da água também aumenta.
![]()
A água pode ferver sem necessidade de aquecimento quando num recipiente aberto, no vácuo (pressão nula) ou em grandes altitudes, 27km, onde a pressão é muito baixa.
![]()

Nos dias frios, quando uma pessoa expele ar pela boca, forma-se uma espécie de “fumaça” junto ao rosto.
Isso ocorre porque a pessoa expele ar quente e úmido que se esfria, ocorrendo a condensação dos vapores expelidos.
![]()
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases.
Nele, para uma dada substância:

![]() Curva CB
Curva CB ![]() fornece a temperatura e a pressão, de fusão ou solidificação e essa curva representa a curva de fusão onde os estados sólido e líquido estão em equilíbrio.
fornece a temperatura e a pressão, de fusão ou solidificação e essa curva representa a curva de fusão onde os estados sólido e líquido estão em equilíbrio.
![]() Curva CD
Curva CD ![]() fornece a temperatura e a pressão, de vaporização ou condensação e essa curva representa a curva de vaporização onde os estados líquido e vapor estão em equilíbrio.
fornece a temperatura e a pressão, de vaporização ou condensação e essa curva representa a curva de vaporização onde os estados líquido e vapor estão em equilíbrio.
![]() Curva AC
Curva AC ![]() fornece a temperatura e pressão, de sublimação ou cristalização e essa curva representa a curva de sublimação onde os estados sólido e vapor estão em equilíbrio.
fornece a temperatura e pressão, de sublimação ou cristalização e essa curva representa a curva de sublimação onde os estados sólido e vapor estão em equilíbrio.
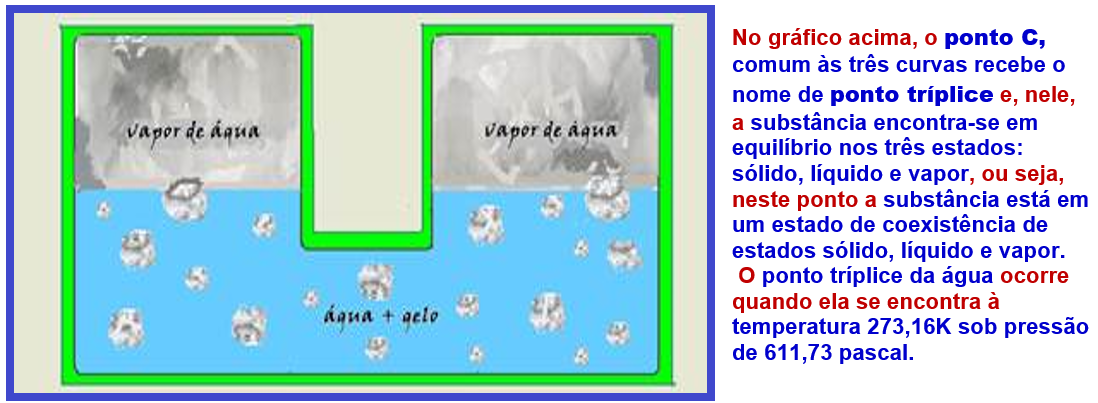
Neste gráfico, o ponto C, comum às três curvas recebe o nome de ponto tríplice e, nele, a substância encontra-se em equilíbrio nos três estados: sólido, líquido e vapor.
