Calor Latente – Trocas de calor com mudança de estado
Calor Latente – Trocas de calor com mudança de estado
Calor Latente
O calor recebido por um corpo pode fazer com que sua temperatura aumente ou que ele sofra uma mudança de estado. No segundo caso você tem uma quantidade de calor latente, ou seja, o calor
latente se refere à quantidade de calor que um corpo recebe apenas para mudar de estado, o que ocorre à temperatura constante.
Constata-se que a quantidade de calor latente (Q) cedida ou retirada de uma substância para que ela mude de estado o que sempre ocorre à temperatura constante é diretamente proporcional à sua massa (m), e depende das características da substância (L). Matematicamente:

Significado de Calor Latente
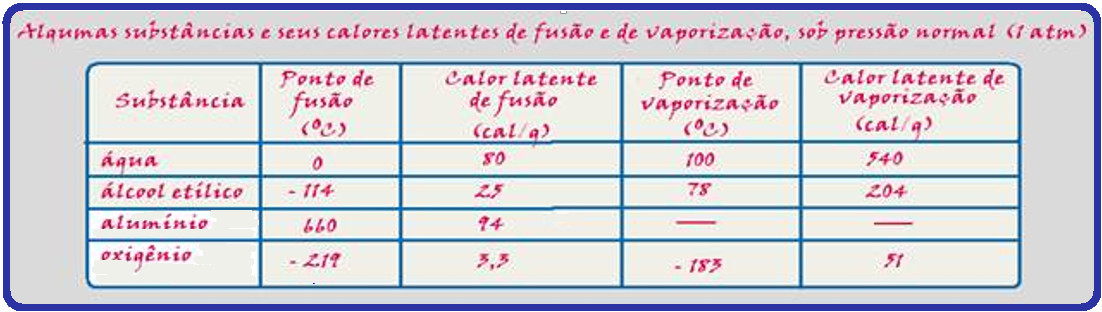
Se você quiser saber, por exemplo, quantas calorias são necessárias para fundir 200g de alumínio, você deve fazer ![]() Q = m.L = 200.94
Q = m.L = 200.94 ![]() Q = 18.800 cal ou Q = 18,8 kcal.
Q = 18.800 cal ou Q = 18,8 kcal.
Curva de aquecimento – calor sensível e calor latente
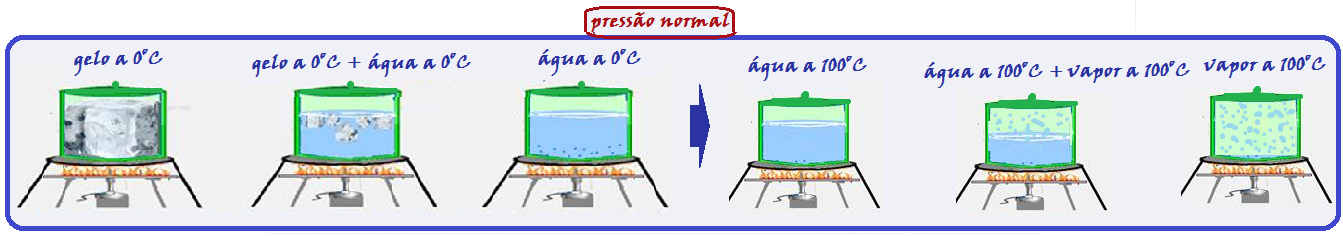
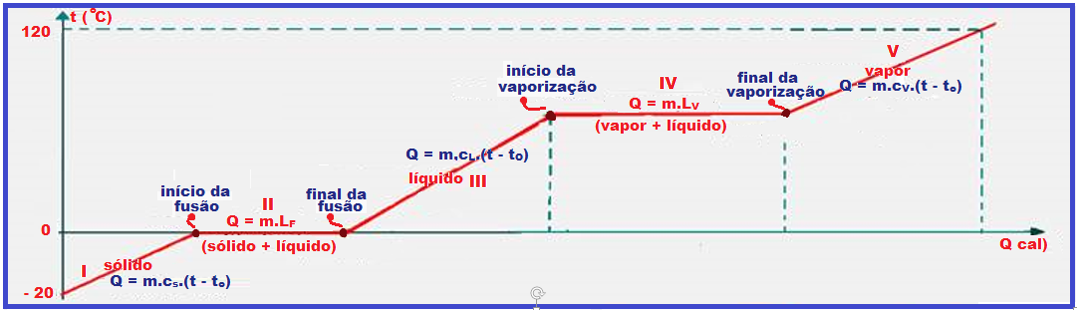
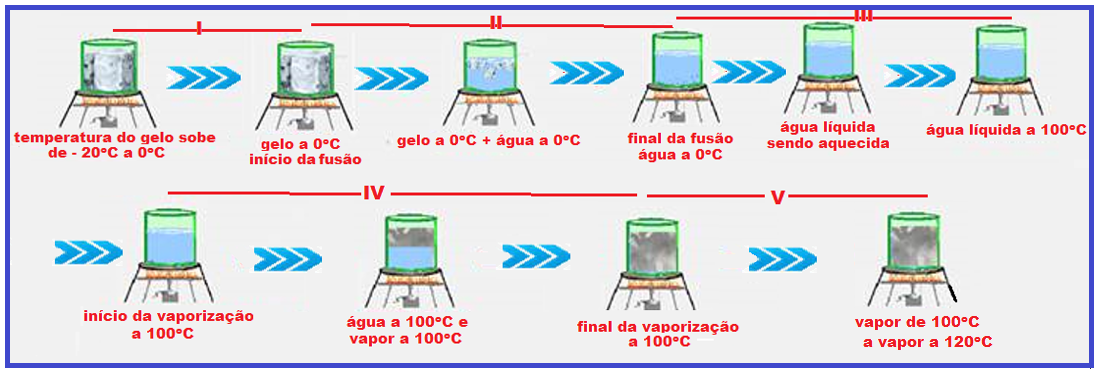
Observe com muita atenção o gráfico abaixo e a sequência de figuras que ilustra o aquecimento, por exemplo, de certa massa de água sendo aquecida de gelo a -20oC até vapor de água a 120oC.
O que você deve saber, informações e dicas
![]()
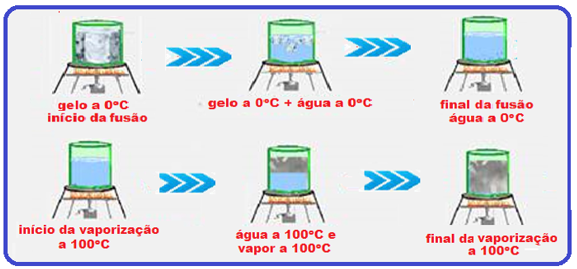
Durante a fusão e a vaporização a temperatura permanece constante (0oC na fusão e 100oC na
vaporização) porque a energia térmica (calor) fornecida ao gelo foi utilizada apenas para convertê-lo em água líquida e a energia térmica (calor) fornecida à água líquida foi utilizada apenas para convertê-la em vapor, fazendo com que a temperatura nessas duas mudanças de estado físico permaneça constante (0oC na fusão e 100oC na vaporização).
![]()
Quando você afirma que o calor latente de fusão do gelo é de 80 cal/g, você quer dizer que, para a fusão de 1g de gelo ou para a solidificação de 1g de água, você deve ceder ou retirar 80 cal.
![]()
Curva de aquecimento – calor sensível e calor latente

![]()
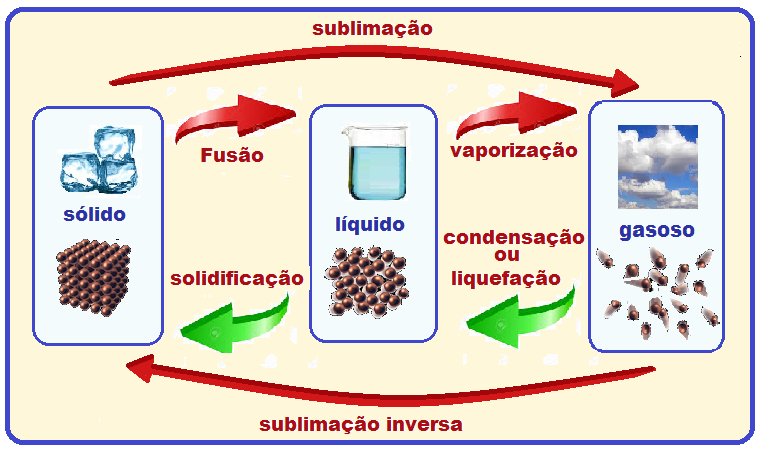
Mudanças de estado físico
![]()
Resolvendo alguns exercícios sobre trocas de calor envolvendo calor sensível (específico) e calor latente:

Dados: calor específico do gelo = 0,5 cal/g°C; calor específico da água = 1 cal/g°C e calor latente de fusão do gelo = 80 cal/g
Resolução:
De gelo a -20oC a gelo a 0oC ![]() não tem mudança de estado
não tem mudança de estado ![]() calor sensível
calor sensível ![]() Q1 = m.cgelo.
Q1 = m.cgelo.
∆θ = 2.0,5.[0 – (-20)] ![]() Q1 = 20kcal (calor utilizado no aquecimento do gelo).
Q1 = 20kcal (calor utilizado no aquecimento do gelo).
De gelo a 0oC a água a 0oC ![]() é uma mudança de estado (fusão) à temperatura constante
é uma mudança de estado (fusão) à temperatura constante ![]() calor latente de fusão
calor latente de fusão ![]() Q2 = m.L = 2.80
Q2 = m.L = 2.80 ![]() Q2 = 160 kcal (calor utilizado apenas na mudança de estado).
Q2 = 160 kcal (calor utilizado apenas na mudança de estado).
De água a 0oC a água a 50oC ![]() não tem mudança de estado
não tem mudança de estado ![]() calor sensível
calor sensível ![]() Q3 = m.cágua. ∆θ = 2.1.(50 – 0)
Q3 = m.cágua. ∆θ = 2.1.(50 – 0) ![]() Q3 = 100 kcal (calor utilizado no aquecimento da água até a temperatura pedida, 50oC).
Q3 = 100 kcal (calor utilizado no aquecimento da água até a temperatura pedida, 50oC).
A quantidade de calor total nesse aquecimento foi Qtotal = 20 + 160 + 100 = 280 kcal.
Como a fonte térmica fornece 20 kcal por minuto ![]() Δt =
Δt = 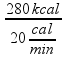 = 14minx60 = 840 s.
= 14minx60 = 840 s.

Num piquenique, com a finalidade de se obter água gelada, misturou-se num garrafão térmico, de
capacidade térmica desprezível, 2kg de gelo picado a 0°C e 3kg de água que estavam em garrafas ao ar livre, à temperatura ambiente de 40oC.
Desprezando-se a troca de calor com o meio externo e conhecidos o calor latente de fusão do gelo (80 cal/g) e o calor específico da água (1 cal/g°C).
Calcule a massa de água gelada disponível para se beber, em kg, depois de estabelecido o equilíbrio térmico
Resolução:
Calor necessário para fundir os 2 kg de gelo a 0 °C ![]() Q1 = m.L = 2000.80 = 160000 cal (calor utilizado para derreter os 2 kg de gelo).
Q1 = m.L = 2000.80 = 160000 cal (calor utilizado para derreter os 2 kg de gelo).
Calor necessário para resfriar os 3 kg de água de 40oC até 0 °C ![]() Q = m.c.Δθ = 3000.1.(0-40) =
Q = m.c.Δθ = 3000.1.(0-40) =
– 120000 cal (calor retirado dos 3 kg de para passar de 40oC até 0oC.
Observe que o calor liberado pela água, 120 kcal, não é suficiente para fundir todo gelo (visto que são necessários 160 kcal) ![]() portanto o equilíbrio térmico ocorrerá a 0 °C, sendo que os 3 kg de água líquida original continuará líquida e teremos uma parte do gelo derretida que vale
portanto o equilíbrio térmico ocorrerá a 0 °C, sendo que os 3 kg de água líquida original continuará líquida e teremos uma parte do gelo derretida que vale ![]() Q = m.L
Q = m.L ![]() 120000 = m.80
120000 = m.80 ![]() m =
m = 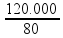 = 1500 g = 1,5 kg.
= 1500 g = 1,5 kg.
Assim a massa de água gelada final será de 3 kg (líquido já existente a 0oC) + 1,5 kg (gelo que derreteu) = 4,5 kg.
