Átomo de Bohr – Estrutura Atômica
Resolução comentada dos exercícios de física sobre
Estrutura Atômica – Átomo de Bohr
01- Quando o elétron salta novamente para sua órbita original, de níveis de energia mais baixos, o que faz com que a energia seja liberada através da emissão de um fóton luminoso. — R- B
02- R- D — veja teoria
03- I. Falsa — não é contínua, só pode ter valores determinados.
II. Correta.
III. Correta.
R- D
04- ΔE=h.f=h.c/λ — 3,4.10-19=6,6.10-34.3.108/λ — λ=5.824.10-10 m — R- B
05- Observe que para saltar do nível 1 (n1) para o nível zero (n∞), onde o elétron se ioniza, foram gastos (E1 – E∞)=│-13,6 – 0│= 13,6 eV — como recebeu 20 eV e gastou 16,3 eV, vão sobrar — 20,0 – 13,6=6,4 eV — R- C
06- R- C — veja teoria
07- Lembre-se de que a velocidade de todas as cores e de todas as radiações eletromagnéticas é sempre a mesma no vácuo e, aproximadamente no ar (3,0.108m/s) — cada cor tem velocidades diferentes em outros meios homogêneos e transparentes (vidro, água, etc.) — a energia de cada cor é diretamente proporcional à freqüência (f) e inversamente proporcional ao comprimento de onda (λ) — da tabela, o menor λ, a mais energética é a violeta — R- C
08- Na transição de 2 para 1 — ΔE=(-3,4) – (-13,6) — ΔE=10,2 eV — compatível com f2, que será absorvido — De 3 para 1 — ΔE=(-1,5) – (-13,6) — ΔE=12,1 eV — compatível com f1, que será absorvido — de 3 para 2 — ΔE=(-1,5) – (3,4) — ΔE=1,9 eV — incompatível com f3, que não será absorvido — R- f1 e f2.
09- Quando a transição ocorrer de um nível mais alto de energia para um nível mais baixo (órbita mais externa para órbita mais interna), ocorre a emissão de um fóton — como ao menor comprimento de onda corresponde a maior freqüência e consequentemente maior nível energético você deve escolher a alternativa em que ocorre maior variação de energia — R- C
10- │ΔE│x= hc/λ=4,13.10-15.3.108/1,03.10-7 — │ΔE│x=12.03 eV — │ΔE│y= hc/λ= 4,13.10-15.3.108/4,85.10-7 — │ΔE│y=
2,55 eV — os valores mais próximos são de 2 e 6 — │ΔE│2= 13,6 – 1,51=12,09 — │ΔE│6=3,40 – 0,85=2,55 — R- B
11- ΔE=E2 – E1=(-3,4) – (-13,6) — ΔE=10,2 eV=10,2.1,6.10-19 — ΔE= 16,3.10-19J — ΔE=h.f — f=16,3.10-19/6,63.10-34 — f=2,5.1015Hz
12- a) Pelo gráfico, a intensidade é máxima quando f=1,8.1013 Hz — c=λf — 3.108=λ.1,8.1013 — λ=1,7.10-5m
b) Estimando a área, considere a pessoa como um cilindro de 0,3m de diâmetro e altura 1,7m — A=2πRh + 2πR2=2.3.0,15.1,7 + 2.3.(0,15)2 — A≈1,7m2 — Po=E/Δt — σA(T4 – T4a) = E/9.104 — 6.10-8.1,7.((37 + 273)4 – (27 + 273)4)=E/9.104 —
10,2.10-8.(3104 – 3004)=E/9.104 — E=10,2.10-8.9.104.(9.235.210.000 – 8.100.000.000) — E≈1,04.107 J
13- Se os fótons foram emitidos, o elétron pulou da órbita 2 para a 1 — E2 – E1= -3,40 – ( -13,6) — ΔE= + 10,2 eV — R- D
14- O exercício está afirmando que a freqüência do vermelho é menor que a do verde — a freqüência é diretamente proporcional ao nível energético — Evermelho < Everde — a freqüência é inversamente proporcional ao comprimento de onda λ e consequentemente ao nível energético E — λvermelho > λverde — R- B
15- Para o átomo de hidrogênio — (E4 – E1)=- 13,6(1/(n4)2 – (n1)2) — ΔE= – 13,6.(1/16 – 1/1) — ΔE= – 13,6.(-15/16) —
ΔE= +12,75 eV — ou — ΔE=12,75.1,6.10-19=20,4.10-19J — ΔE=h.f — 20,4.10-19=6,63.10-34.f — f=3,07.1015 Hz
16- Nas radiografias os ossos saem brancos e tecidos em volta negros — isso ocorre porque o osso, cuja estrutura é mais densa que a do tecido mole, absorve mais radiação ficando com aparência clara enquanto que o tecido mole, menos denso, é atravessado pelos raios X, ficando com aparência mais escura — R- C
17- Lembre-se de que a energia dos fótons de luz é diretamente proporcional à frequência da luz f — como a freqüência da luz amarela, do sódio, é menor, então sua energia também é menor — a velocidade de propagação de todas as cores e de todas as radiações eletromagnéticas é sempre a mesma no ar e no vácuo (c=3,0.108m/s) — R- A
18- Basta substituir na equação, que é fornecida, lembrando que a velocidade v é c (velocidade da luz) — V2=2GM/R — R=2GM/c2 — R=2.6,67.10-11.5,98.1024(3.108)2 — R≈9.10-3m — diâmetro d=2R=2.9.10-3=18.10-3=0,018m=1,8cm
19- Fissão Nuclear — reação que se inicia com o choque de um nêutron com um núcleo instável que proporciona a quebra deste último e, por este motivo, é chamado de fissão nuclear (divisão do núcleo) — Fusão Nuclear – é o processo no qual dois ou mais núcleos atômicos se juntam e formam um outro núcleo de maior número atômico.

O principal tipo de fusão que ocorre no interior das estrelas é o de Hidrogênio em Hélio, onde dois prótons se fundem em uma partícula alfa (um núcleo de hélio), liberando dois pósitrons, dois neutrinos e energia.
20- 
R- B
21- R- D — veja teoria
22- E1=Eo — n=1 — E1=-Eo/12 — E1=-Eo — n=4 — E4=-Eo/42 — E4=Eo/16 — E1 – E4=(-Eo) – (-Eo/16) — ΔE1,4=(-15/16).Eo — R- D
23- Observe no gráfico 1 a queda de intensidade de radiação quando os raios X atravessam a parte maciça do cilindro em teste — no gráfico 2 você observa que a metade esquerda do cilindro, em comparação com o gráfico 1, deve ser maciça e a metade direita oca — R- E
24- R- A — veja teoria
25- A força nuclear forte é a responsável pela atração mútua entre os nêutrons e prótons do núcleo atômico — a força nuclear fraca participa das transmutações atômicas — a força elétrica está associada aos campos elétricos criados em torno das cargas elétricas
— a força gravitacional é uma das mais presentes em nosso cotidiano, haja vista que nosso peso é uma manifestação gravitacional — R- C
26- Velocidade da luz no vácuo — c = 3.108 m/s — constante de Planck — h = 6,6.10-34 J·s = 4,1.10-15 eV·s — combinando a equação fundamental da ondulatória com a equação de Planck — E=h.c/λ — para a linha Hα — λ=656,3.10-9 — E=4,1.10-15.
3.108/653,6.10-9 — E≈1,88 eV — R- D
27- De acordo com o postulado de Bohr, o elétron excitado passa para um nível mais energético — Ao sofrer decaimento para o nível estacionário, ele emite um fóton, que dependendo da frequência, poderá ser ou não na forma de luz visível — R- A
28- (I) Incorreta — intensidade de radiação emitida aumenta com a temperatura — I=σ.T4 — portanto, T3 > T1.
(II) Correta — pelo gráfico
(III) Incorreta — pelo gráfico, vemos que o comprimento de onda para o qual a radiação é máxima é menor para T3.
(IV) Incorreta. Já justificado em (I).
(V) Incorreta. Já justificado em (I).
R- E
29- A lei de Stefan-Boltzmann afirma que a potência total irradiada pelo corpo negro é diretamente proporcional à área (S) da superfície emissora e diretamente proporcional à quarta potência da temperatura absoluta (T): P = sST4 — a equação do efeito fotoelétrico dada por Einstein afirma que quando uma onda eletromagnética de alta frequência atinge uma chapa metálica, cada fóton pode arrancar um único elétron que é ejetado com energia cinética máxima (K) dada pela expressão — K = h f – W, sendo h a constante de Planck, f a frequência da onda incidente e W o trabalho para arrancar o elétron do metal — a equação de Louis de Broglie concilia as características ondulatórias e corpusculares dos fenômenos relacionados à luz, através da equação — λ=h/Q, sendo l o comprimento de onda associado ao movimento da partícula que se desloca com quantidade de movimento (momento linear) Q — R- C
30- a) Os fótons incidentes que podem ser absorvidos são determinados a partir das diferenças de energia entre os estados inicial (nível fundamental) e final (1º, 2º ou 3º nível) — aqueles fótons cujas energias coincidem com uma das diferenças de energia entre os níveis mostrados na figura poderão ser absorvidos — as diferenças de energia entre os estados inicial e final são dadas por — DEf3 = – 0,85 – ( -13,60) = 12,75eV (nível fundamental e 3o nível) — DEf2 = – 1,51 – ( -13,60) = 12,09eV (nível fundamental e 2onível) — DEf1 = – 3,40 – ( -13,60) = 10,20eV (nível fundamental e 1o nível) — logo, os fótons que podem ser absorvidos pelo átomo de hidrogênio no estado fundamental são aqueles cujas energias são respectivamente iguais a: 12,09 eV, quando o átomo é excitado do estado fundamental para o 2º nível, e 10,20 eV, quando o átomo é excitado do estado fundamental para o 1º nível.
b)
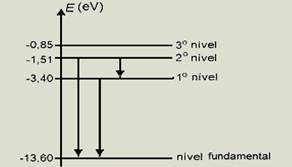
c) As energias dos fótons emitidos são determinadas a partir da diferença de energia entre o nível inicial e o nível final — portanto, os fótons emitidos terão as seguintes energias — DE2f = -1,51 – ( -13,60) = 12,09eV — DE1f = -3,40 – ( -13,60) = 10,20eV — DE21 = -1,51 – ( – 3,40) = 1,89eV
31- 1. Tomando os níveis 0, 1 e 2 de energias Eo, E1 e E2, tal que Eo < E1 < E2 (ver representação na figura acima) para transições do nível 2 para o 0, temos duas hipótese — 1ª hipótese — emissão de 1 fóton de energia E = h . f – E2 – Eo — 2ª hipótese — emissão de 2 fótons de energias E’ = h . f’ = E2 – E1 e E” = h . f” = E1 – Eo — por conservação da energia — (E2 – Eo) = (E2 – E1) + E1 – Eo) — E = E’ + E’ e assim, h . f = h . f’ + h . f” — f = f’ + f” — portanto, cada frequência pode ser a soma ou a diferença entre outras.
2. Os comprimentos de onda que limitam a região do visível são l = 4,0.10-7 m e l’ = 7,0.10-7m (tabela de constantes), que correspondem, respectivamente, às frequências f=3.108/4.10-7 — f=7,5.1014 Hz — f’=3.108/7.10-7 — f’=4,3.1014 Hz
32- R- A — veja teoria
33- R- B — veja teoria
34- a) E=h.c/ λ — 1,98.10-15=6,6.10-34.3.108/λ — λ=19,8.10-26/1,98.10-15 — λ=10-10m — λ=1 A
b) Q – quantidade de movimento — λ=h/mv — λ=h/Q — Q=h/λ=6,6.10-34/10-10 — Q=6,6.10-24 kg.m/s
35- R- D
36-

R- A
37-

R- A
38- Observe que na reação para a formação de uma molécula de glicose surgem seis moléculas de CO2 — energia necessária — E=6.2,34.10-18J — E=1,404.10-17J — freqüência f da radiação eletromagnética — c=λf — 3.108=6,80.10-7f — f=4,4.1014Hz — equação de Planck — E=n.h.f — n – número de fótons absorvidos — 1,404.10-7=n.6,62.10-34.4,4.1014 — n≈48 — R- C
39- Observe que o pedido é a razão R entre a intensidade do campo magnético no CMS (BCMS) e do campo magnético da Terra (BTerra) — n=BCMS/BTerra=4/30.10-6 — n≈133.333 vezes — R- A
40- a) Dado — Eo = 13,6 eV — pela conservação da energia, a energia (E) do fóton emitido é em módulo, igual à variação da energia do elétron — E=│Eo/22 – Eo/12│=│13,6/4 – 13,6│ — E=10,2 e
b) Dados — E = 10,2 eV; 1 eV = 1,6.10-19 J — MP = 1,6.10-27 kg — c = 3.108 m/s — Q=E/c — conversão de elétron-volt para joule — E = 10,2 (1,6.10-19) J — pela conservação da quantidade de movimento, o próton adquire quantidade de movimento de mesma intensidade que o fóton, em sentido oposto — assim, sendo v a velocidade adquirida pelo próton —
│Qfóton│= │Qpróton│ — E/c=Mp.V — V=E/(MP.c) — V=10,2.1,6.10-19/1,6.10-27.3.108 — V=3,4m/s
41- a) nágua=c/vágua — 1,3=3.108/Vágua — Vágua≈ 2,3.108m/s
b)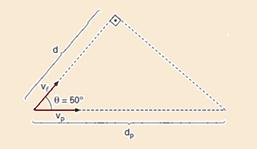
Observe na figura — cos50o=d/dp — 0,64=1,6/dp — dp=2,5m — sendo a velocidade da radiação Cerenkov constante — Vp=ΔS/Δt — Vp=dp/Δt — a radiação Cerenkov percorre a distância dp no mesmo intervalo de tempo em que a luz percorre a distância d nesse meio — Vp=2,5/12.10-9 — Vp≈2,1.108m/s
42- Observe a figura, que mostra o elétron movendo-se em uma de suas órbitas, sendo — m – massa do elétron — e – carga elementar – módulo da carga do próton que é igual ao módulo da carga do elétron=e — e – raio da órbita do elétron — k – constante eletrostática — a força eletrostática (![]() ) trocada entre o próton e o elétron age como resultante centrípeta (
) trocada entre o próton e o elétron age como resultante centrípeta (![]() ) — Fe=FC — mV2/r=k.e.e/r2 — mV2=ke2/r — multiplicando ambos os membros por ½ — mV2/2 = ke2/2r (I) — a energia (E) do elétron é a soma da sua energia cinética (Ec) com a sua energia potencial (Ep) — E=Ec + Ep (II) — com o referencial no infinito — Ep= – ke2/r (III) — substituindo (I) e (III) em (II) — E=ke2/2r – ke2/r — E= – ke2/2r (IV) — de acordo com o enunciado,
) — Fe=FC — mV2/r=k.e.e/r2 — mV2=ke2/r — multiplicando ambos os membros por ½ — mV2/2 = ke2/2r (I) — a energia (E) do elétron é a soma da sua energia cinética (Ec) com a sua energia potencial (Ep) — E=Ec + Ep (II) — com o referencial no infinito — Ep= – ke2/r (III) — substituindo (I) e (III) em (II) — E=ke2/2r – ke2/r — E= – ke2/2r (IV) — de acordo com o enunciado,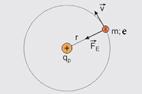
o comprimento (C) da órbita é igual a um número inteiro (n) de comprimentos de onda (λ) do elétron — C=nλ — 2πr=nλ — r=nλ/2π (V) — substituindo (V) em (IV) — E= – ke2/2(nλ/2π) — E= – kπe2/nλ
43-
Dados — carga do próton — qp=e — carga do quark u — qu=2/3e — calculando a carga do quark down — do enunciado — p=u + u + d — qp=2qu + qd — e=2.(2/3)e + qd — e=(4/3)e + qd — qd= – (1/3)e — considere que o nêutron seja formado de x quarks up e y quarks down — como sua carga é nula — x + y = 3 — x(2/3)e + y(-1/3)e = 0 — 2x – y = 0 — y=2x — X + 2x=3 — x=1 — y=2 — conclui-se que um nêutron é formado de 1 quark up e 2 quarks down (n=udd)
44- a) Falsa — A fissão nuclear — divisão de um núcleo atômico pesado em dois núcleos mais leves.
b) Correta — Durante a fusão nuclear ocorre grande liberação de energia, já que as massas dos núcleos produzidos são inferiores as dos núcleos iniciais. Parte da massa perdida durante a fusão nuclear é convertida em energia, de acordo com a Equação de Einstein E=MC2. Estas fusões nucleares explicam o calor e a luz do Sol, percebidos por nós, aqui na Terra.
c) Falsa — veja b.
d) Falsa — veja b.
e) Falsa — veja b.
R- B.
45-
Veja no esquema abaixo a soma das massas dos reagentes e a soma das massas dos produtos da reação — diferença entre a soma dessas massas — ∆m=236,05 – 235,88=0,17 uma — equação de Einstein de equivalência entre massa e energia — E= ∆m.c2 — E=0,17uma=0,17.930MeV — E=158,1 MeV. (essa energia é liberada principalmente sob forma de energia cinética).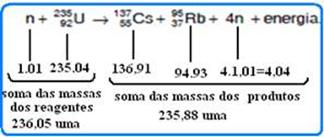
• Decaimento alfa (α) – emissão de partículas α (núcleo de 4He) — decaimento beta (β) – emissão, pelo núcleo, de partículas β (cargas negativas, elétrons) — decaimento gama (γ) – emissão de raios gama (fótons de alta energia).
46- a) Do texto — “Segundo todos os cálculos, as futuras usinas de fusão nuclear poderão extrair de 1 metro cúbico de água uma quantidade de energia igual à de 2 mil barris de petróleo” — regra de três — 1 m3 – 2.103 barris — 100 m3 – n barris —
n=2.103.102 — n=2.105 barris de petróleo — como cada barril contém 1,5.106 kcal, 2.105 barris conterão — W=2.105 barris x
1,5.106kcal/barril — W=3,0.1011 kcal=3,0.1014cal — do enunciado — 1 BEP (Barril Equivalente de Petróleo), equivale a 1,45.109 cal — regra de três — 1 BEP – 1,45.109 cal — n’ BEP – 3.1014 cal — n’=3.1014 cal/1,45.109 cal —
n’≈2,07.105 BEP.
b) Do texto: “Os centros dos núcleos dos átomos de hidrogênio devem estar a 1.10-15 metros um do outro para que ocorra a fusão” — ainda do texto — “essa fusão é o processo no qual dois núcleos de átomos leves (por exemplo, o hidrogênio – cujo núcleo é constituído por 1 próton com carga elétrica elementar é 1,6.10-19C) se combinam, ou se fundem, constituindo um elemento mais pesado. Os núcleos, então, carregados positivamente, devem se aproximar suficientemente um do outro, ou seja, vencer a força de repulsão eletrostática entre eles” — portanto, são dados — d=1.10-15m — .|Q1|= |Q2|=1,6.10-19C — k=9.109N.m2/C2 — Lei de Coulomb — F=k.|Q1|. |Q2|./d2 = 9.109.1,6.10-19.1,6.10-19/(1.10-15)2 — F=23,04.101 — F=230,4 N.
47-
As duas leis estabelecidas por Phillip Lenard para o efeito fotoelétrico são:
1ª Lei: para determinada frequência, o número de elétrons emitidos (conhecidos como fotoelétrons) pela placa iluminada (emissora) é proporcional à intensidade da luz nela incidente.
2ª Lei: a energia cinética dos fotoelétrons depende da frequência da radiação incidente na placa emissora, não dependendo da intensidade dessa radiação.
Como, na situação b, a intensidade da luz incidente na placa emissora é o dobro em relação à situação a, de acordo com a 1ª lei, o número de elétrons liberados também é o dobro, provocando corrente elétrica também duas vezes maior — ib = 2 ia — como se trata da mesma radiação nas duas situações (mesma frequência), a 2ª lei garante que energia cinética dos fotoelétrons também é a mesma, exigindo o mesmo potencial elétrico de frenamento (-Vo) — R- C
Voltar para os exercícios
