Segunda lei da Termodinâmica
Segunda lei da Termodinâmica
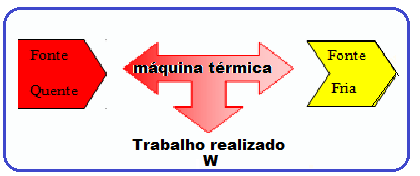
Máquinas térmicas
Máquina térmica pode ser qualquer dispositivo capaz de transformar a energia interna de um combustível em energia mecânica.
Também pode ser definida como o dispositivo capaz de transformar parte de calor em trabalho.

Observe esse exemplo: o motor de um carro é a fonte quente, local onde ocorre a queima do combustível, que fornece o calor que é resultante da explosão dos gases do combustível.
Dessa fonte térmica é retirada, a cada ciclo, uma quantidade de calor. (1)
Parte deste calor é convertida em trabalho mecânico útil (energia útil), fazendo o carro se mover.
A outra parte do calor que não é aproveitada é rejeitada para a atmosfera (meio ambiente), fonte fria, por meio do escapamento. (2)
Ocorre conservação de energia no motor de um carro pois a mistura gasosa, que realiza trabalho, é eliminada pelo escapamento com temperatura maior do que antes da explosão, logo parte do calor de combustão é transformada em energia interna dos gases, além da troca de calor que ocorre entre a carcaça do motor e o ambiente.
Portanto, a parte restante do calor de combustão é devida a energia de movimento do pistão, ou seja, realização de trabalho.
Então, os motores de combustão interna também obedecem a Primeira Lei da termodinâmica, ou seja ΔU = Q – W.
Ciclo em termodinâmica
Em termodinâmica, ciclo é definido como uma série de transformações termodinâmicas sucessivas e organizadas tais que, ao transcurso de todas elas, o sistema regresse a seu estado inicial; ou seja, que a variação das grandezas termodinâmicas próprias do sistema seja nula.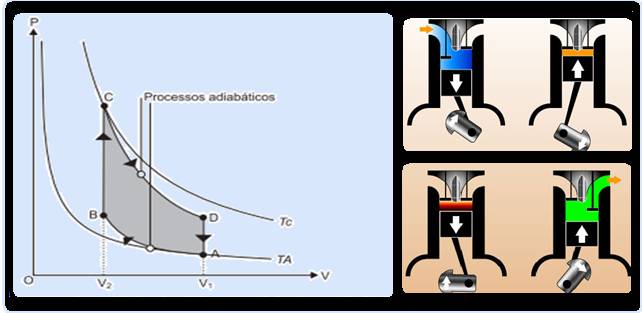
Um fato característico dos ciclos termodinâmicos é a aplicação da lei da conservação de energia: a soma de calor e trabalho recebidos pelo sistema deve ser igual à soma de calor e trabalho realizados pelo sistema.
Transformações reversíveis e irreversíveis
Transformações reversíveis ![]() são aquelas que se realizam em ambos os sentidos, podendo voltar ao estado inicial, passando pelas mesmas situações intermediárias, sem influências do meio externo, ou seja, processos reversíveis são aqueles que, teoricamente, são completamente reversíveis, podendo realizar a trajetória inversa do processo.
são aquelas que se realizam em ambos os sentidos, podendo voltar ao estado inicial, passando pelas mesmas situações intermediárias, sem influências do meio externo, ou seja, processos reversíveis são aqueles que, teoricamente, são completamente reversíveis, podendo realizar a trajetória inversa do processo.
Fontes de energia renováveis são aquelas que se renovam continuamente na Natureza, sendo, por isso inesgotáveis.
Isso ocorre geralmente em transformações mecânicas sem atrito.
Considere o bloco da figura sendo abandonado do repouso no ponto A.
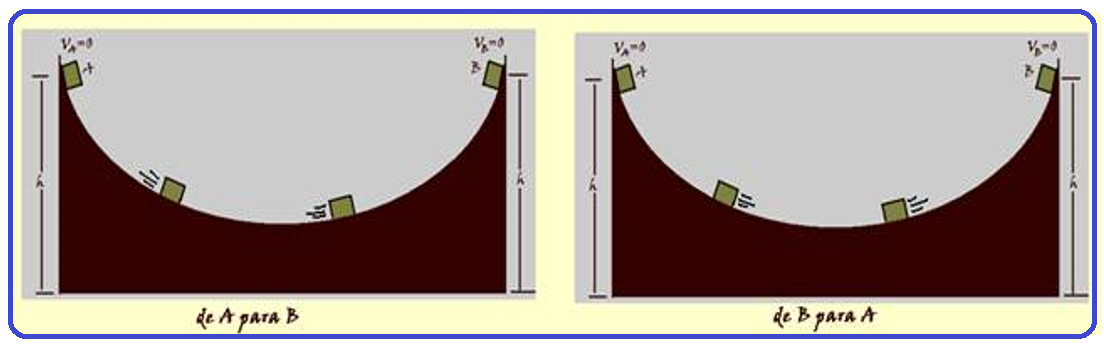
Se você desprezar todos os atritos ele se deslocará até o ponto B, atingindo o repouso na mesma altura que a do ponto A, retornará a A e ficará oscilando entre A e B, pois não existe atrito.
Observe que no deslocamento entre A e B e o retorno entre B e A, a transformação produzida não teve nenhuma influência do meio exterior (corpos circundantes) e, assim, ela é uma transformação reversível.
Transformações irreversíveis ![]() observe no exemplo anterior que, se houver atrito, o corpo sofre perda de energia e, portanto não poderia, espontaneamente, voltar à posição inicial.
observe no exemplo anterior que, se houver atrito, o corpo sofre perda de energia e, portanto não poderia, espontaneamente, voltar à posição inicial.
Nesse caso, essa é uma transformação irreversível, onde sua inversa só pode ocorrer com influência do meio externo ou de corpos circundantes, que devem fornecer energia ao corpo para que ele retorne à posição inicial (ponto A).
Fontes de energia não renováveis são aquelas cujas reservas se esgotam, pois o seu processo de formação é muito lento comparado com o ritmo de consumo que o ser humano faz delas.
Na realidade, na natureza todas as transformações espontâneas são irreversíveis. No exemplo acima é muito improvável que você elimine totalmente o atrito e, devido ao choque com as moléculas de ar e outros atritos, o bloco, depois de certo tempo irá parar.
A energia do bloco se converteu em energia térmica. O contrário não ocorre, ou seja, é impossível na natureza, que as moléculas se reorganizem e empurrem o bloco fazendo-o retornar à posição inicial. É por esse motivo que surgiu o Princípio da Degradação da Energia que afirma que é impossível converter totalmente calor em trabalho.
As transformações não alteram a quantidade de energia do Universo. Embora permaneça inalterada, em cada transformação, a parcela da energia disponível torna-se cada vez menor.
Na maioria das transformações parte da energia converte em calor, que ao se dissipar caoticamente pela vizinhança torna-se, cada vez menos disponível, para realização de trabalho.
A energia total do Universo não muda, mas a parcela disponível para realização de trabalho, torna-se cada vez menor.
Entropia
Em termos de termodinâmica, entropia é a medida de desordem das partículas em um sistema físico.
Maior temperatura, maior movimento vibratório das partículas, maior desordem e consequentemente maior entropia.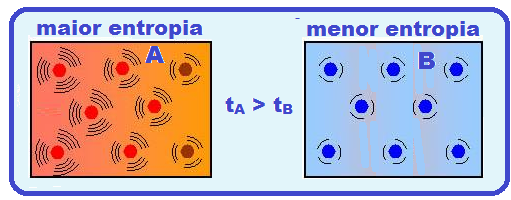
Menor temperatura, menor movimento vibratório das partículas, menor desordem e
consequentemente menor entropia.
As entropias são espontâneas, isso quer dizer que seguem princípios da natureza, sendo irreversíveis.

Por exemplo, quando um prato cai no chão e quebra, o resultado da desorganização gerada é a entropia deste ato, no entanto, seria impossível refazer o prato, sendo impossível retroceder a entropia.
Mais considerações sobre a entropia
A entropia pode ser considerada como o nível de desorganização de um sistema.
Exemplo: Escreva os números de 0 a 9 em pedaços de papéis (sistema), deixe-os ordenados em sua mão e em seguida jogue-os para cima deixando-os cair na mesa.
Você observará que todas foram espalhadas de maneira desordenada na mesa.
A medida quantitativa da desordem desse sistema (os 10 números) corresponde à entropia.
Quanto maior o grau de desorganização do sistema, maior a entropia.
Espontaneamente você verá que jamais os números voltarão de maneira ordenada à sua mão, a não ser que você os pegue e os ordene, mas aí, o processo não será mais espontâneo, pois será realizado um trabalho para que isso ocorra.
Quando um motor, por exemplo, de um carro estiver funcionando (energia útil), parte da energia recebida é dissipada por atritos e essa energia dissipada é a entropia e você nunca mais conseguirá reutiliza-la pelo processo inverso.
A degradação natural da energia também é uma evolução para a desordem.
As energias ordenadas (mecânica, elétrica, química) tendem a se converter na energia desordenada de agitação térmica (calor) que não pode retornar a ser ordenada e vai aumentando cada vez mais.
O Segundo Princípio da Termodinâmica diz precisamente isso, que um sistema isolado tende a evoluir no sentido de aumentar a entropia. Por isso que a entropia do universo aumenta continuamente, pois os acontecimentos inversos não acontecem.
Quanto maior a temperatura de uma substância, maior o movimento das suas partículas, mais desorganizada ela está e, portanto, maior a sua entropia, assim, à temperatura de zero absoluto (0K ou – 273o C) quando todas as vibrações atômicas e movimento param, a entropia é nula, porque não há movimento desordenado.
Segundo Princípio da Termodinâmica
Pode-se definir o Segundo Princípio da Termodinâmica da seguinte maneira: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho”

É impossível transformar calor de uma fonte quente (Qq) em energia útil (trabalho W) sem que ocorra perdas para a fonte fria Qf).
Você pode reduzir essas perdas, por exemplo, diminuindo os atritos, mas nunca eliminá-las totalmente.
Rendimento de uma máquina térmica
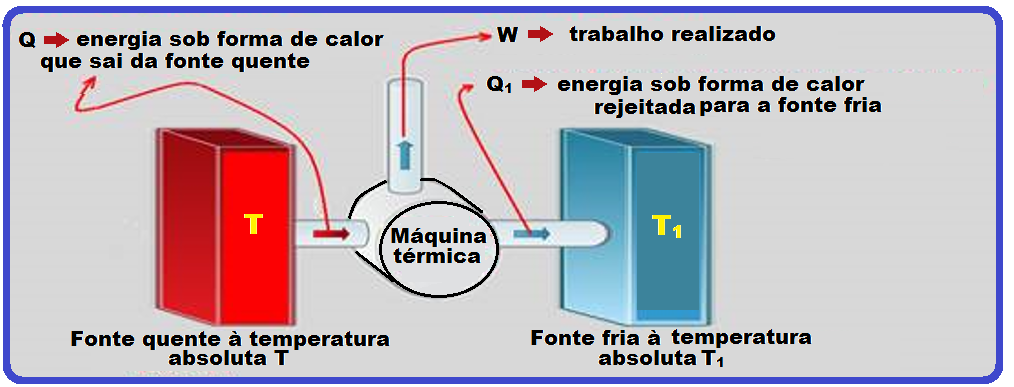
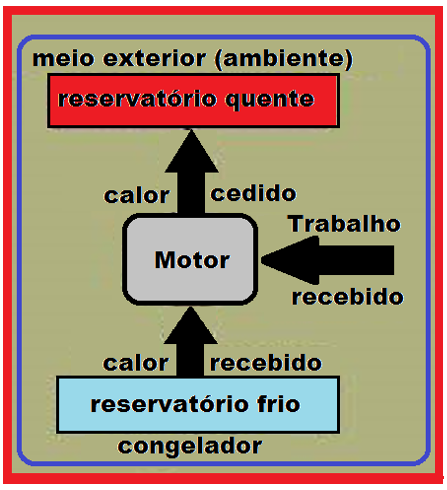
Uma máquina térmica é um dispositivo constituído por dois reservatórios (figura).
O calor flui do reservatório à temperatura elevada (fonte quente) para o reservatório à temperatura mais baixa (fonte fria), obedecendo à Segunda Lei da termodinâmica e transformado parte do calor que sai da fonte quente em trabalho.
Se você conhecer o quanto de trabalho (W) a máquina térmica produz e o quanto de calor (Q) foi fornecido pela fonte quente, você pode calcular o rendimento (η) de uma máquina térmica.
Rendimento (η) de uma máquina térmica ![]() η =
η = 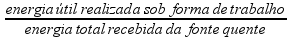
![]()
Uma máquina térmica é um dispositivo constituído por dois reservatórios (figura).
O calor flui do reservatório à temperatura elevada (fonte quente) para o reservatório à temperatura mais baixa (fonte fria), obedecendo à Segunda Lei da termodinâmica e transformado parte do calor que sai da fonte quente em trabalho.
Se você conhecer o quanto de trabalho (W) a máquina térmica produz e o quanto de calor (Q) foi fornecido pela fonte quente, você pode calcular o rendimento (η) de uma máquina térmica.
Rendimento (η) de uma máquina térmica ![]() η =
η = 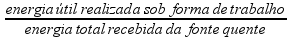
![]()

Observe nessas expressões que a sua eficiência (rendimento) é sempre menor do que 1 (100%).
Lembre-se de que a utilização do módulo de Q é necessária em função da Primeira lei e de que
se o sistema recebe calor, a quantidade de calor é positiva e se o sistema cede calor, a quantidade de calor é negativa.
Ciclo de Carnot
Carnot estabeleceu que: Se uma máquina térmica operar em ciclos entre duas fontes térmicas, uma quente e outra fria, ela deve
retirar calor (Q) da fonte quente, convertê-lo parcialmente em trabalho (W) e o restante (Qr) rejeitar para a fonte fria.
Exemplo: o motor de um carro é a fonte quente, local onde ocorre a queima do combustível, que fornece o calor. Dessa fonte térmica é retirada, a cada ciclo, uma quantidade de calor.
Parte deste calor é convertida em trabalho mecânico útil (energia útil), fazendo o carro se mover. A outra parte do calor que não é aproveitada é rejeitada para a atmosfera, fonte fria, por meio do escapamento.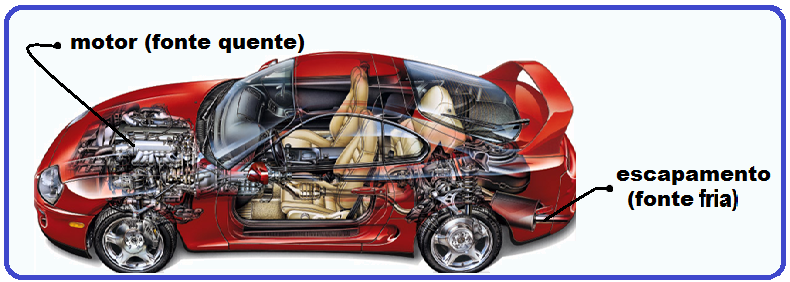
Sequência do ciclo de Carnot
Como o rendimento de uma máquina térmica é sempre menor que 1 (η = 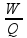 , com W sempre menor que Q), Carnot demonstrou que, teoricamente, existe uma sequência específica de transformações na qual a máquina térmica obtém o máximo de rendimento.
, com W sempre menor que Q), Carnot demonstrou que, teoricamente, existe uma sequência específica de transformações na qual a máquina térmica obtém o máximo de rendimento.
O ciclo no qual isso ocorre é denominado ciclo de Carnot e a máquina que opera segundo esse ciclo é chamada máquina de Carnot.
Por ser ideal e imaginária, a máquina proposta por Carnot não contraria a segunda lei da Termodinâmica.
Sequência do ciclo de Carnot cuja máquina térmica que o realiza é denominada máquina de Carnot:
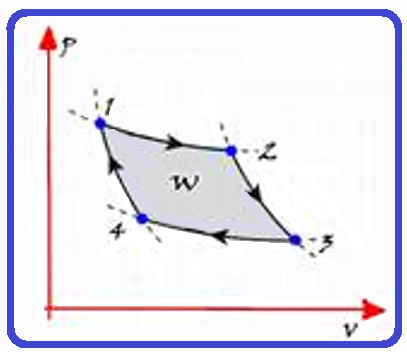
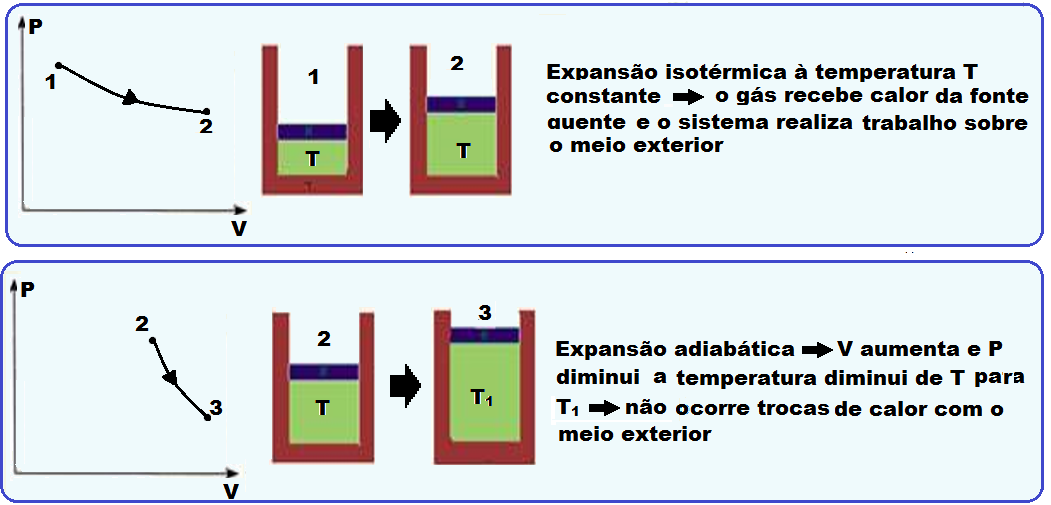
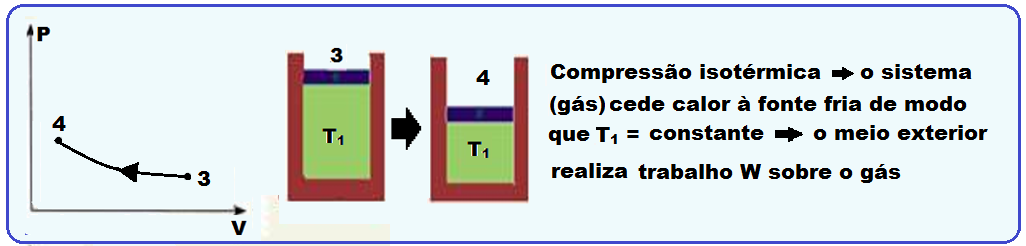
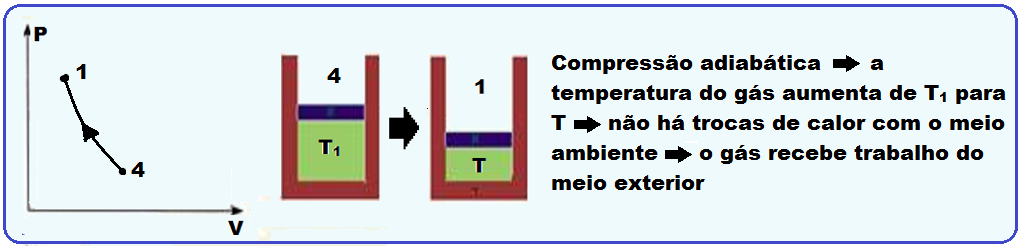
Fórmulas do rendimento de uma máquina de Carnot
Carnot demonstrou que o rendimento (η) de uma máquina térmica depende somente das temperaturas entre as quais ela trabalha ou que, no ciclo de Carnot, o rendimento é função exclusiva das temperaturas absolutas das fontes fria e quente e não depende da substância que faz a máquina térmica funcionar.
Carnot demonstrou que:

Máquinas frigoríficas
Máquinas frigoríficas são dispositivos que, durante seu funcionamento, efetuam a transformação trabalho em calor.
Os refrigeradores são máquinas frigoríficas que, ao funcionarem, transferem calor de um sistema em menor temperatura (congelador) para o meio exterior, que se encontra a uma temperatura mais alta.

As máquinas frigoríficas não contrariam o enunciado da segunda lei da Termodinâmica, que a referida passagem não é espontânea, ocorrendo à custa de um trabalho externo.
No refrigerador das geladeiras comuns existe um líquido refrigerante (freon, tetrafluoretano, etc,), que, ao sofrer expansão passa do estado líquido ao estado gasoso, que abaixa a temperatura na serpentina interna (congelador).
Esse líquido refrigerante absorve calor do congelador e, através de um mecanismo ele é forçado a entrar no condensador, onde é comprimido até se liquefazer e nessa liquefação cede calor ao ambiente através da serpentina externa. Esse processo se repete ciclicamente.
Eficiência de uma máquina frigorífica
A eficiência (e) de uma máquina frigorífica é expressa pela relação entre a quantidade de calor retirada da fonte fria (Q2) e o trabalho externo (W) envolvido nessa transferência.

O que você deve saber, informações e dicas
![]()
Máquina térmica ![]() pode ser definida como o dispositivo capaz de transformar parte de calor em trabalho.
pode ser definida como o dispositivo capaz de transformar parte de calor em trabalho.
![]()

![]()
Sequência do ciclo de Carnot cuja máquina térmica que o realiza é denominada máquina de Carnot:
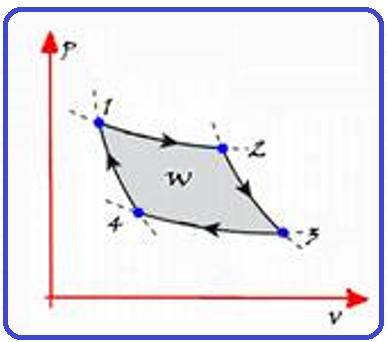
![]()
Rendimento de uma máquina térmica de Carnot:

![]()
Quanto maior a temperatura de uma substância, maior o movimento das suas partículas, mais desorganizada ela está e, portanto, maior a sua entropia, assim, à temperatura de zero absoluto (0K ou -273oC) quando todas as vibrações atômicas e movimento param, a entropia é nula, porque não há movimento desordenado.
![]()
Máquinas frigoríficas são dispositivos que, durante seu funcionamento, efetuam a transformação trabalho em calor.
Os refrigeradores são máquinas frigoríficas que, ao funcionarem, transferem calor de um sistema em menor temperatura (congelador) para o meio exterior, que se encontra a uma temperatura mais alta.
![]()
De acordo com a segunda lei da Termodinâmica, a entropia do Universo tende a aumentar com o tempo.
![]()
Eficiência de uma máquina frigorífica
A eficiência (e) de uma máquina frigorífica é expressa pela relação entre a quantidade de calor retirada da fonte fria (Q2) e o trabalho externo (W) envolvido nessa transferência.

![]()
Analizar atentamente cada sequência do ciclo de Carnot na teoria acima.
![]()
Observe atentamente o processo físico representado na sequência de figuras a seguir.
Considere, para efeito de análise, que a casinha e a bomba constituem um sistema físico fechado.

Note que tal processo é iniciado na figura 1 e é concluído na figura 3.
Pode-se afirmar que, no final dessa sequência, a ordem do sistema é maior que no início e, portanto, durante o processo representado, a entropia do sistema diminui.
Como a entropia refere-se à desordem do sistema, a entropia diminui. Essa situação é impossível, pois a entropia deve sempre ser positiva, maior que zero e sempre aumentar.
Confira os exercícios com resolução comentada
