
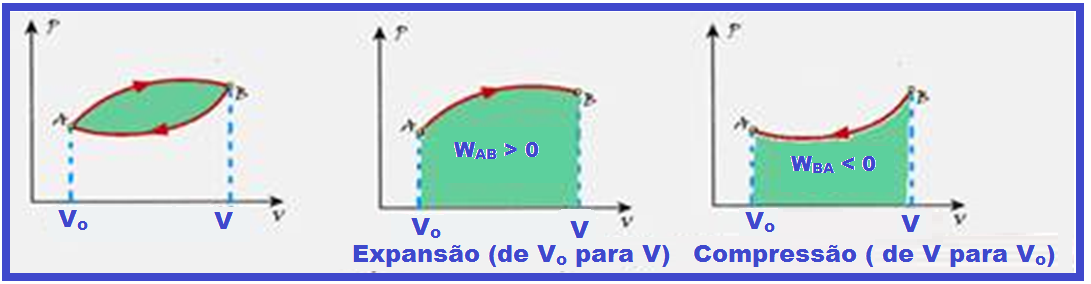
Trabalho de um gás – Transformação cíclica
Transformações de energia
A energia pode passar de uma forma para outra, como, por exemplo, de qualquer tipo de energia para energia térmica (calor) realizando trabalho, situações 1, 2 e 3 e de calor para outros tipos de energia realizando trabalho, situações 4, 5 e 6.




Termodinâmica é a parte da Termologia que estuda as relações entre calor e trabalho.
Trabalho (W) na Termodinâmica
Considere
um gás
contido no interior do cilindro de êmbolo móvel
da figura sendo mantido sob
pressão
constante
através do peso
![]() .
.

Ele é aquecido e passa de uma situação inicial com pressão Po, volume Vo e temperatura To, com o êmbolo sofrendo um deslocamento d, para uma situação final com pressão final Po(isobárica), volume V e temperatura T.
O
gás
aplica sobre o êmbolo uma força de intensidade F
que o faz sofrer
um deslocamento d,
de tal forma que o trabalho
realizado pela força F vale
![]() W
= F.d (I)
W
= F.d (I) ![]() pressão
exercida pelo gás
sobre
o êmbolo
pressão
exercida pelo gás
sobre
o êmbolo
![]() P
=
P
=
 (S – área do êmbolo)
(S – área do êmbolo) ![]() F
= P.S (II).
F
= P.S (II).
Substituindo
II em I
![]() W
= F,d.S
W
= F,d.S
![]() observe que S.d
representa o volume de gás deslocado (ΔV = V – Vo)
observe que S.d
representa o volume de gás deslocado (ΔV = V – Vo)
![]() W
= P.ΔV ou W = P.(V – Vo).
W
= P.ΔV ou W = P.(V – Vo).

Diagrama de Clapeyron numa transformação isobárica

Trabalho positivo ou trabalho negativo
Na expressão W = P.(V – Vo), como a pressão P é sempre positiva:
![]() Se
V
> Vo
Se
V
> Vo
![]() W
> 0
W
> 0 ![]() o sistema
(gás)
em expansão
realiza trabalho sobre o meio exterior (ambiente).
o sistema
(gás)
em expansão
realiza trabalho sobre o meio exterior (ambiente).
![]() Se
V
< Vo
Se
V
< Vo
![]() W
< 0
W
< 0
![]() o meio
exterior (ambiente) realiza trabalho sobre o sistema (gás).
o meio
exterior (ambiente) realiza trabalho sobre o sistema (gás).
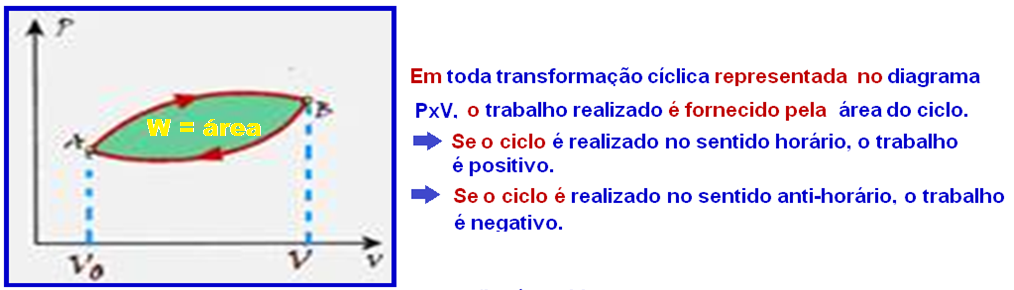
Transformação cíclica ou fechada
Numa transformação cíclica ou fechada os estado inicial e final do gás coincidem.
Começa em A (estado inicial), sofre uma transformação chegando a B e, em seguida, outra transformação chegando novamente a A.

Decompondo a transformação fechada ABA, em duas abertas AB e BA, o trabalho total da transformação cíclica é a soma
algébrica das áreas hachuradas, ou seja, W = WAB + WBA.

O que você deve saber, informações e dicas
![]()

![]()

![]()
![]() Se
V
> Vo
Se
V
> Vo
![]() W
> 0
W
> 0 ![]() o sistema
(gás)
em expansão
realiza trabalho sobre o meio exterior (ambiente).
o sistema
(gás)
em expansão
realiza trabalho sobre o meio exterior (ambiente).
![]() Se
V
< Vo
Se
V
< Vo
![]() W
< 0
W
< 0
![]() o meio
exterior (ambiente) realiza trabalho sobre o sistema (gás).
o meio
exterior (ambiente) realiza trabalho sobre o sistema (gás).
![]()
Numa
transformação isocórica
ou isométrica ou isovolumétrica,
o volume
é constante,
então ΔV
= 0
e como W
= P.ΔV
![]() W=P.0
W=P.0
![]() W
= 0.
W
= 0.
![]()
![]()

![]()
Você pode transformar calor (Q) em trabalho (W) e vice-versa através da relação 1cal = 4,186J, ou W = J.Q onde J = 4,186 (constante de conversão = equivalente mecânico do calor).
![]()

Exercícios de vestibulares com resolução comentada sobre
Trabalho de um gás – Transformação cíclica
01-(UFMS-MS) Sem variar sua massa, um gás ideal sofre uma transformação a volume constante. É correto afirmar que
a) a transformação é isotérmica.
b) a transformação é isobárica.
c) o gás não realiza trabalho.
d) sua pressão diminuirá,se a temperatura do gás aumentar.
e) a variação de temperatura do gás será a mesma em qualquer escala termométrica.
02-(Uneb-BA) Um gás ideal sofre uma expansão isobárica, variando seu volume de 2 m3até 5 m3. Se o trabalho realizado sobre o gás foi de 30J, a pressão mantida durante a expansão, em N/m2, foi de:
![]()
03-(PUCCAMP-SP) O biodiesel resulta da reação química desencadeada por uma mistura de óleo vegetal com álcool de cana.
A utilização do biodiesel etílico como combustível no país permitiria uma redução sensível nas emissões de gases poluentes no ar, bem como uma ampliação da matriz energética brasileira.
O combustível testado foi desenvolvido a partir da transformação química do óleo de soja. É também chamado de B-30 porque é constituído de uma proporção de 30% de biodiesel e 70% de diesel metropolitano. O primeiro diagnóstico divulgado considerou performances dos veículos quanto ao desempenho, durabilidade e consumo.
Um
carro-teste consome 4,0 kg de biodiesel para realizar trabalho
mecânico. Se a queima de 1 g de biodiesel libera 5,0 .103 cal
e o rendimento do motor é de 15%, o trabalho mecânico realizado, em
joules, vale, aproximadamente,
Dado: 1 cal = 4,2 joules
![]()

05-(UFB) A figura anexa é o gráfico da expansão de um gás perfeito. Pede-se o trabalho realizado pelo gás nas transformações:

a) AB b) BC c) CD e) AD
06-(UNIFESP-SP) O diagrama PV da figura mostra a transição de um sistema termodinâmico de um estado inicial A para o estado final B, segundo três caminhos possíveis.

O caminho pelo qual o gás realiza o menor trabalho e a expressão correspondente são, respectivamente,

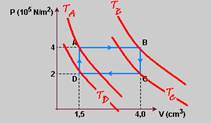
07-(UFRRJ-RJ) Um gás ideal sofre as transformações AB, BC, CD e DA, de acordo com o gráfico a seguir.

Através da análise do gráfico, assinale adiante a alternativa correta.
a) Na transformação CD, o trabalho é negativo.
b) A transformação AB é isotérmica.
c) Na transformação BC, o trabalho é negativo.
d) A transformação DA é isotérmica.
e) Ao completar o ciclo, a energia interna aumenta.
08-(UFRRJ-RJ) Certa massa gasosa, contida num reservatório, sofre uma transformação termodinâmica no trecho AB. O gráfico mostra o comportamento da pressão P, em função do volume V.

O módulo do trabalho realizado pelo gás, na transformação do trecho AB, é de:
a) 400J.
b) 800J.
c) 40kJ.
d) 80kJ.
e) 600J.
09-(UFMG-MG) Um gás ideal, em um estado inicial i, pode ser levado a um estado final f por meio dos processos I, II e III, representados neste diagrama de pressão versus volume:

Sejam
WI,
WII e
WIII os
módulos dos trabalhos realizados pelo gás nos processos I, II e
III, respectivamente.
Com base nessas informações, é correto
afirmar que:
a) WI <
WII <
WIII
b) WI =
WII =
WIII
c) WI =
WII >
WIII
d) WI >
WII >
WIII.
10-(Uenf-RJ) Um gás perfeito sofre uma transformação que pode ser representada no diagrama abaixo.

Calcule:
a) a relação entre as temperaturas nos estados A e C.
b) o trabalho realizado pelo gás na transformação ABC.
11-(Uneb-Ba) Um gás ideal sofre uma expansão isobárica, variando seu volume de 2 m3até 5 m3. Se o trabalho realizado sobre o gás foi de 30J, a pressão mantida durante a expansão, em N/m2, foi de:
![]()
12-(FUVEST-SP) A figura mostra o corte transversal de um cilindro de eixo vertical com base de área igual a 500cm2 , vedado em sua parte superior por um êmbolo de massa m que pode deslizar sem atrito.
O cilindro contém 0,50 mol de gás que se comporta como ideal. O sistema está em equilíbrio a uma temperatura de 300K e a altura h, indicada na figura, vale 20cm. Adote para a constante dos gases o valor R = 8,0 J/mol, para a aceleração da gravidade o valor10m/s2 e para a pressão atmosférica local o valor 1,00 x 105N/m2. Determine:
a)
A massa do êmbolo em kg.
b) Determine o trabalho W realizado pelo gás quando sua temperatura é elevada lentamente até 420K.
13-(UFPE-PE) Uma caixa cúbica metálica e hermeticamente fechada, de 4,0 cm de aresta, contém gás ideal à temperatura de 300

K e à pressão de 1 atm. Qual a variação da força que atua em uma das paredes da caixa, em N, após o sistema ser aquecido para 330 K e estar em equilíbrio térmico? Despreze a dilatação térmica do metal.
14-(UFPE-PE) Um cilindro de 20 cm2 de seção reta contém um gás ideal comprimido em seu interior por um pistão móvel, de massa desprezível e sem atrito. O pistão repousa a uma altura ho = 1,0 m. A base do cilindro está em contato com um forno, de forma que a temperatura do gás permanece constante.

Bolinhas de chumbo são lentamente depositadas sobre o pistão até que o mesmo atinja a altura h = 80 cm. Determine a massa de chumbo, em kg, que foi depositado sobre o pistão. Considere a pressão atmosférica igual a 1 atm=105N/m2 e g=10m/s2
15-(FGV-SP) O diagrama relaciona valores de pressão e volume que ocorrem em determinada máquina térmica.

De sua análise, pode-se inferir que
a) se a linha 2 fosse uma reta ligando os pontos A e B, ela representaria uma expansão isotérmica do gás.
b) a área compreendida entre as duas curvas representa o trabalho realizado sobre o gás no decorrer de um ciclo completo.
c) a área formada imediatamente abaixo da linha indicada por 1 e o eixo V equivale, numericamente, ao trabalho útil realizado pelo gás em um ciclo.
d) o ciclo representa os sucessivos valores de pressão e volume, que ocorrem em uma máquina podendo ser, por exemplo, uma locomotiva a vapor.
e) no ponto indicado por A, o mecanismo apresenta grande capacidade de realização de trabalho devido aos valores de pressão e volume que se associam a esse ponto.
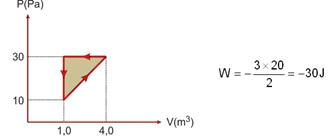
16-(PUC-SP) Uma amostra de gás ideal sofre o processo termodinâmico cíclico representado no gráfico a seguir.

Ao completar um ciclo, o trabalho, em joules, realizado pela força que o gás exerce nas paredes do recipiente é
![]()
17-(UERJ-RJ) Observe o ciclo mostrado no gráfico P × V a seguir.

Considerando este ciclo completo, o trabalho realizado, em joules, vale:
![]()
18-(UFC-CE) Um gás ideal sofre as transformações mostradas no diagrama da figura a seguir.

Determine o trabalho total realizado durante os quatro processos termodinâmicos ABCDA.
19-(CFT-MG) O diagrama P × V da figura refere-se a um gás ideal, passando por uma transformação cíclica.

O ponto em que a temperatura se apresenta mais alta corresponde a __________; e o trabalho realizado pelo gás, no processo AB, é __________ joules.
A opção que completa, corretamente, as lacunas é
![]()
20-(UFRGS-RS) O gráfico a seguir representa o ciclo de uma máquina térmica ideal.

O trabalho total realizado em um ciclo é
a) 0 J. b) 3,0 J. c) 4,5 J. d) 6,0 J. e) 9,0 J.
21-(UEL-PR) Uma dada massa de gás perfeito realiza uma transformação cíclica, como está representada no gráfico pV a seguir. O trabalho realizado pelo gás ao descrever o ciclo ABCA, em joules, vale:

a) 3,0·10-1.
b) 4,0·10-1.
c) 6,0·10-1.
d) 8,0·10-1.
e) 9,0·10-1.
22-(UECE-CE)

No diagrama P-V a seguir, quatro processos termodinâmicos cíclicos executados por um gás, com seus respectivos estados iniciais, estão representados. O processo no qual o trabalho resultante, realizado pelo gás é menor é o

![]()
23-(PUC-RJ)

Uma quantidade de gás passa da temperatura de 27oC = 300K a 227oC = 500K, por um processo a pressão constante (isobárico) igual a 1 atm = 1,0 x 105 Pa.
a) Calcule o volume inicial, sabendo que a massa de gás afetada foi de 60 kg e a densidade do gás é de 1,2 kg/m3.
b) Calcule o volume final e indique se o gás sofreu expansão ou contração.
c) Calcule o trabalho realizado pelo gás.
24-(UDESC-SC)

Um gás em uma câmara fechada passa pelo ciclo termodinâmico representado no diagrama p x V da Figura.

O trabalho, em joules, realizado durante um ciclo é:
![]()
25-(UNIOESTE-PR)

A figura abaixo apresenta o diagrama pV para o ciclo fechado de uma máquina térmica que usa um gás ideal monoatômico como substância de trabalho. Considerando p1, p2 e p3 respectivamente como as pressões nos pontos 1, 2 e 3, as informações da figura e que p2=5·p1, pode-se afirmar:
I. O processo 1→2 é isocórico e o processo 3→1 isobárico.
II. O trabalho realizado sobre o sistema (gás monoatômico) no processo 1→2 é maior que zero joule.
III. O calor transferido ao sistema (gás monoatômico) no processo 3→1 é menor que zero joule.
IV. A temperatura no ponto 3 é 5 vezes maior do que aquela no ponto 1.
V. A variação da energia interna do sistema é nula no ciclo 1231.
Considere
as afirmações acima e assinale a alternativa correta.
A. A afirmativa V e falsa.
B. As alternativas I e II são verdadeiras.
C. As alternativas I, II e IV são falsas.
D. Todas as alternativas são falsas.
E. As alternativas I, III e IV são verdadeiras.
26-UFF-RJ)

O ciclo de Stirling é um ciclo termodinâmico reversível utilizado em algumas máquinas térmicas. Considere o ciclo de Stirling para 1 mol de um gás ideal monoatônico ilustrado no diagrama PV.

Os processos AB e CD são isotérmicos e os processos BC e DA são isocóricos.
Preencha a tabela para a pressão, volume e temperatura nos pontos A, B, C, D. Escreva as suas respostas em função de PA, VA, PC, VC e

de R (constante universal dos gases). Justifique o preenchimento das colunas P & T.
b) Complete a tabela com os valores do calor absorvido pelo gás (Q), da variação da sua energia interna (ΔU) e do trabalho realizado pelo

gás (W), medidos em Joule, em cada um dos trechos AB, BC, CD e DA, representados no diagrama PV. Justifique o preenchimento das colunas para Q e ΔU.
Resolução comentada dos exercícios de vestibulares sobre
Trabalho de um gás – Transformações cíclicas
01- R- C --- veja teoria
02- W=P.ΔV --- 30=P(5 – 2) --- P=10N/m2(Pa) --- R- A
03- 1g – 5.103cal --- 4.000g – Q cal --- Q=2.107cal --- 1cal – 4,2J --- 2.107cal – W J --- W=8,4.107J --- rendimento de 15% --- Wútil=0,15.8,4.107=1,26.107 J --- R- E
04- Trata-se de uma transformação de calor (gerado pela queima do combustível) em trabalho (movimentação do veículo) ---
R- A
05- a) WAB=área do triângulo=b.h/2=10.10/2 --- WAB=50 J
b) WBC=área do retângulo=b.h=(20 – 10).10 --- WBC=100 J
c) WCD= zero
d) WAD=50 + 100 + 0 --- WAD=150 J
06- Observe que o menor trabalho corresponde à menor área, que é a hachurada na figura abaixo ---
W=área do retângulo=b.h -- W=(V2 – V1).P2 --- R- B
07- Trecho CD --- WCD=P.ΔV=P.(VD – VC)=5,8.(0,8 – 1,6) --- WCD= - 4,64 J --- R- A
08- O trabalho no trecho AB é numericamente igual à área do trapézio, hachurada na figura, e de
valor W=(B + b).h/2=(30.104 +10.104).20.10-2/2/2 --- W=400.102J=40.103J --- W=40kJ --- R- C
09- Observe as áreas que fornecem os respectivos trabalhos:
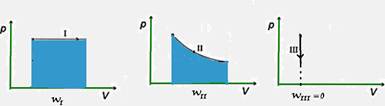
R- D
10- a) De A para B --- isovolumétrica --- PA/TA=PB/TB --- 5/TA=2/TB --- TA=5/2TB (I) --- de B para C --- isobárica --- VB/TB=VC/TC --- 2/TB=5/TC --- TB=2/5TC (II) --- comparando I com II --- TA=TC ou TA/TC=1
b) Trabalho pela área --- WAB=0 --- WBC=P.(VC – VB)=2(5 – 2) --- WBC=6J --- Wtotal= 0 + 6 --- Wtotal=6J
11- W=P.ΔV --- 30=P(5 – 2) --- P=10N/m2(Pa) --- R- A
12- a) V=S.h=500.20=103 cm3 --- V=104.10-6 --- V=10-2 m3 --- PV=nRT --- (105 + 10m/5.10-2).10-2 = 0,5.8.300 --- 103 + 2m=1,2.103 --- m=102kg
b) isobárica --- Vo/To=V/T --- S.0,2/300=S.h/420 --- h=0,28m --- W=P.ΔV=1,0.105.5.10-2.(0,28 – 0,20) --- W=400J
13- Volume
da caixa --- V=ℓ3=(4.10-2)3
--- V=64.10-6m3
--- área de cada parede --- S=ℓ2=(4.10-2)2
--- S=16.10-4m2
--- a 300K --- pressão nas paredes ---
P=1atm=105N/m2 ---
P=F1/S
--- 105=F1 /16.10-4
--- F1=160N
--- a 330K --- cálculo da pressão no final desta
transformação que é isovolumétrica --- Po/To=P/T
--- 105/300=P/330
--- P=1,1.105N/m2
--- P=F2/S
--- 1,1.105=F2/16.10-4
--- F2=176N
--- ΔF=F2 –
F1=176
– 160 --- ΔF=16N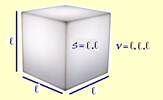
14- Antes --- Pa=Patm=1atm=105N/m2 --- Va=S.h=20.10-4.1 --- Va=2.10-3m3 --- depois --- Pd=Patm + P=P + 105 --- Vd=S.h --- Vd=20.10-4..0,8 --- Vd=1,6.10-3m3 --- isotérmica --- PaVa=Pd.Vd --- 105.2.10-3=(P + 105).1,6.10-3 --- P=25.103N/m2 --- na situação depois, a pressão com que o êmbolo comprime o gás vale --- pressão=força/área=peso/área --- 25.103=peso/20.10-4 ---
peso=50N --- peso=m.g --- 50=m.10 --- m=5,0kg
15- R- B --- veja teoria e lembre-se de que nesse caso o trabalho é negativo (sentido anti-horário).
16- Como a transformação cíclica é no sentido horário, o trabalho realizado é positivo (predomina a expansão – do gás sobre o ambiente) e fornecido pela área do ciclo --- W=base x altura=((0,3 – 0,1).(30 – 10) --- W= + 4J --- R- B
17- W positivo – sentido horário --- W=(5 – 2).(800 – 300) --- W= + 1.500J --- R- A
18- O trabalho é positivo – sentido horário --- área do paralelogramo=base x altura --- W=(6Vo – 2Vo).(P2 – P1) --- W=4Vo.(P2 – P1)
19- A temperatura mais alta corresponde ao ponto cuja isoterma se encontra mais afastada dos
eixos (ponto B) conforme a figura e o trabalho é positivo (sentido horário) e de valor --- W=(4.10-6 – 1,5.10-6).(4.105 – 2.105)=2,5.10-6.2.105 --- W= +5.10-1J ---
R- A
20-

Wtotal=W1 + W2=b1.h1 + b2.h2=(4 – 1).(1) + (7 – 4).(2 – 1)=3 + 3 --- Wtotal= 6J --- R- D
21- W=b.h/2=(6.10-6-2.10-6).(3.105 – 1.105)/2 --- W=4,0.10-1J --- R- B
22- Em toda transformação cíclica o trabalho realizado é numericamente igual à área interna do ciclo --- observe na figura que a menor área é a do ciclo K (menor que quatro quadrículos) --- R- C
23- a)
d=m/V --- Vo=60,1,2
--- Vo=50m3
b)
Equação geral dos gases perfeitos --- Po.Vo/To =
P.V/T --- 50/300 = V/500 --- V=250/3
--- V=83,3
m3 (V>Vo o
gás sofreu expansão)
c) Expansão isobárica --- W=P.(V – Vo)=105.(83,3 – 50) --- W=33,3.105=3,3.106 J
24- Em um ciclo fechado o trabalho é numericamente igual à área da figura. Seu valor é negativo devido ao sentido anti-horário.
R- E
25-
I. Verdadeira --- observe que o processo de 1 para 2 ocorre à volume constante e que o de 3 para 1 ocorre à pressão constante.
II. Falsa --- observe que nesse processo o volume não varia (∆V=0) e, como W=P.∆V, W=0.
III. Verdadeira --- nesse processo o trabalho é negativo, pois o volume está diminuindo e o meio exterior exerce W sobre o gás.
IV. Verdadeira --- do enunciado --- P2=5P1 --- todos os pontos da mesma curva da isoterma possuem a mesma temperatura --- T2=T3 --- o processo de 1 para 2 é uma isovolumétrica e seu volume não varia (V1=V2=V) --- P1.V/T1 = P2.V/T2 --- P1/T1=P2/T2 --- P1/T1=5P1/T2 --- T2=5T1 --- como T2=T3 --- T3=5T1.
V. Verdadeira --- em todo ciclo a temperatura final e inicial são iguais e, consequentemente não ocorre variação da energia interna do sistema.
R- E.
26- Neste ciclo você tem --- Trecho AB --- isotérmica de expansão --- trecho BC --- isocórica ou
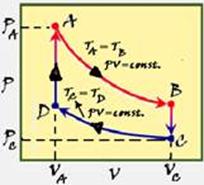
isovolumétrica --- trecho CD --- isotérmica de compressão --- Trecho DA --- isocórica ou isovolumétrica.
As respostas devem ser em função dos dados fornecidos, ou seja, em função de PA, VA, PC e VC.
Primeira linha --- no trecho AB trata-se de uma isotérmica (mesma temperatura TA=TB=T) --- PA.VA/T=PBVB/T ou PA.VA=PB.VB = constante --- equação dos gases perfeitos --- PA.VA=nRTA --- TA=TB=T=PA.VA/nR (I) --- P=PA(dado); V=VA (dado) e T=PA.VA/nR ---segunda linha --- no trecho BC
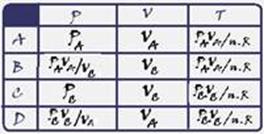
trata-se de uma isocórica ou isovolumétrica (volume constante VB=VC=V) --- do trecho AB --- PA.VA=PB.VB (II) --- do trecho BC (III) --- VB=VC --- (III) em (II) --- PA.VA=PB.VC --- PB=PA.VA/VC --- P= PA.VA/VC; V=VC e T= PA.VA/nR (de I) --- terceira linha --- isotérmica --- TC=TD --- equação dos gases ideais --- PC.VC=nRTC --- TC=PC.VC/nR --- P=PC; V=VC e T= PC.VC/nR --- quarta linha --- analogamente --- P=PC.VC/VA, V=VA e T= PC.VC/nR.
b) * Transformação isotérmica --- como a temperatura (T) e a energia interna (U) de um sistema estão associadas à energia cinética das moléculas, se a temperatura for constante, a energia interna (U) do sistema também será constante. Assim, a variação
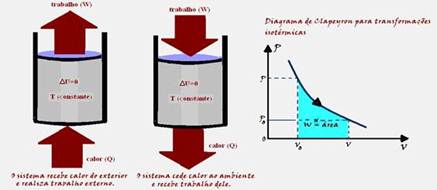
de energia interna (ΔU) do sistema será nula --- ΔU=0 --- ΔU= Q – W --- 0=Q – W --- Q=W --- portanto em toda transformação isotérmica todo calor Q recebido pelo sistema ou cedido por ele é transformado em trabalho W.
* Transformação isocórica, isométrica ou isovolumétrica --- ocorre a volume constante --- Vo=V ---
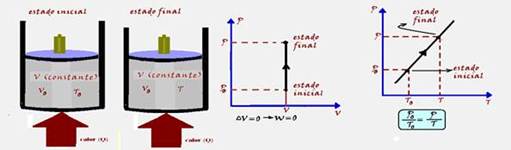
ΔV=0 --- W=P.ΔV --- W=P.0 --- W=0 --- ΔU = Q – W --- ΔU=Q – 0 --- ΔU=Q --- assim, todo o calor (Q) recebido pelo sistema é igual à sua variação de energia interna (ΔU)
Primeira linha --- isotérmica --- ΔU=0 --- Q=W --- Q=300J --- W=Q=300J --- segunda linha ---
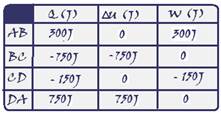
isocórica --- W=0 --- ΔU=Q ---ΔU= -750J --- Q= - 750J --- terceira linha --- isotérmica --- ∆U=0 --- Q=W --- W = -150J --- Q= - 150J --- quarta linha --- isocórica --- W=0 --- ∆U=Q --- Q=750J --- ∆U=750J.