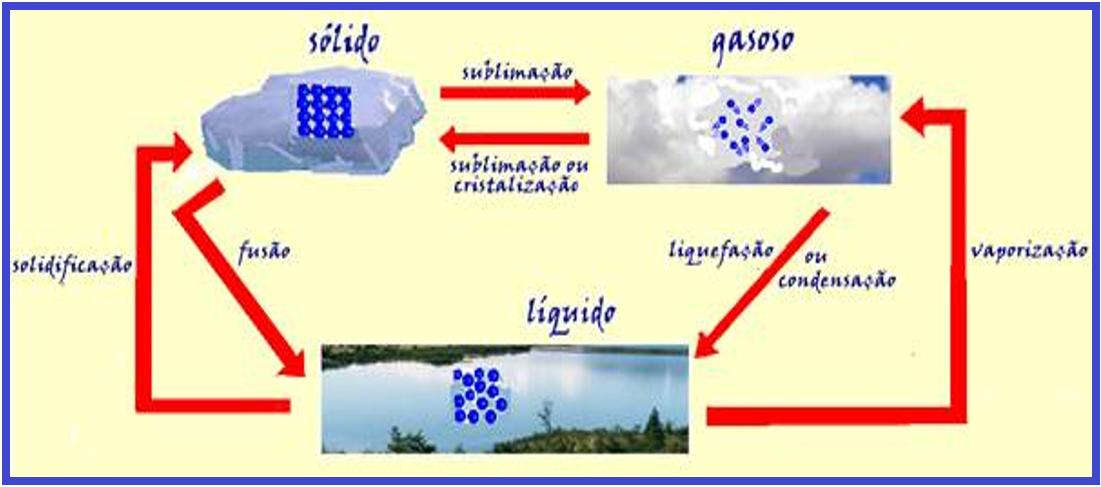
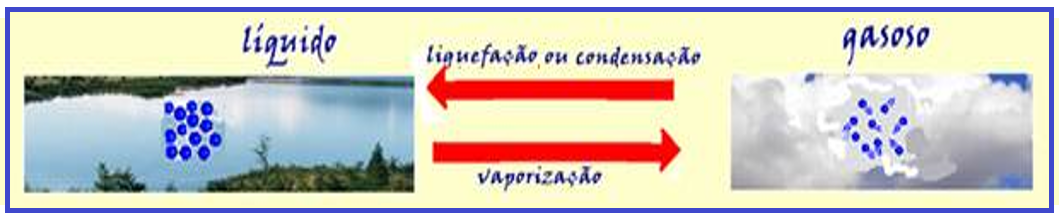
Mudanças de estado físico da matéria
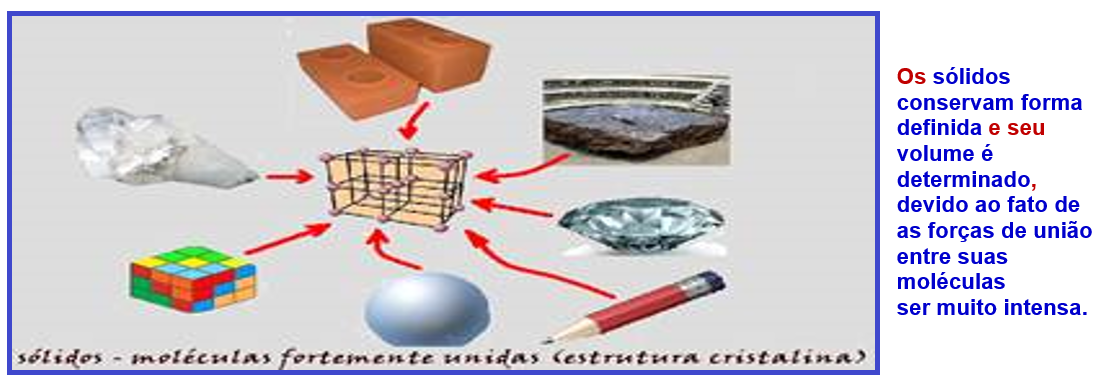
Características moleculares dos sólidos

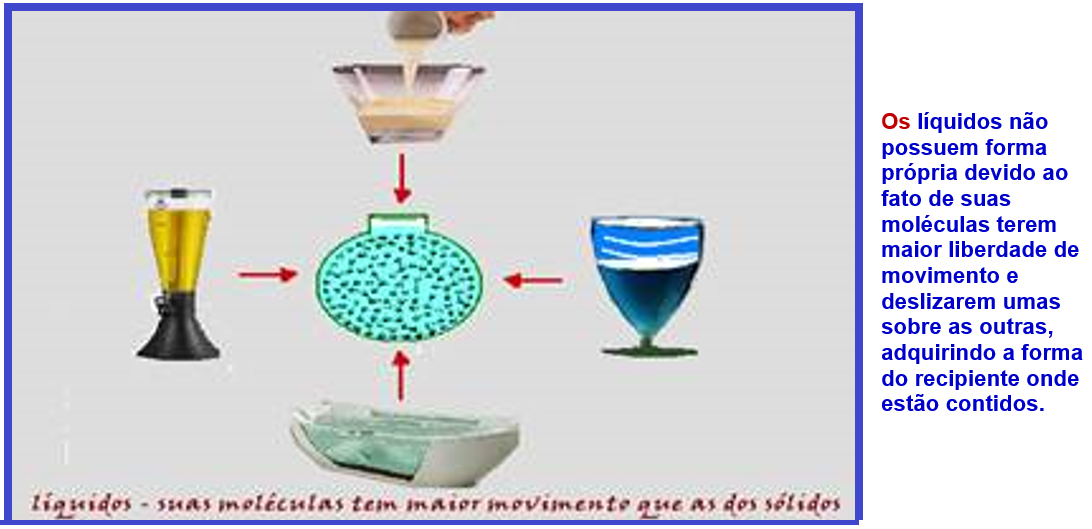
Características moleculares dos líquidos
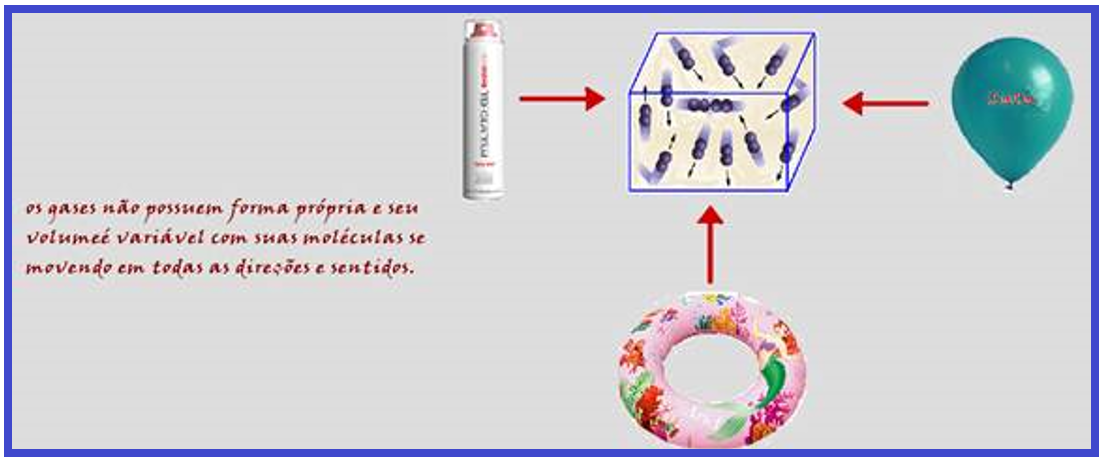
Características moleculares dos gases
Os gases não possuem forma própria e seu volume é variável, já que suas moléculas se deslocam em todas as direções e sentidos.
Observe pelo que foi fornecido acima que, se você quiser fazer com que um corpo mude de estado físico passando de sólido para líquido e depois para gasoso (tem que ser nessa ordem), ele deve receber calor, para aumentar o movimento vibratório de suas moléculas aumentando assim sua temperatura.
Do mesmo modo, a passagem gasoso, líquido e sólido (nessa ordem), só pode ocorrer se o corpo perder calor (diminuir sua temperatura).
Mudanças de estado físico
Temperatura na fusão e na solidificação
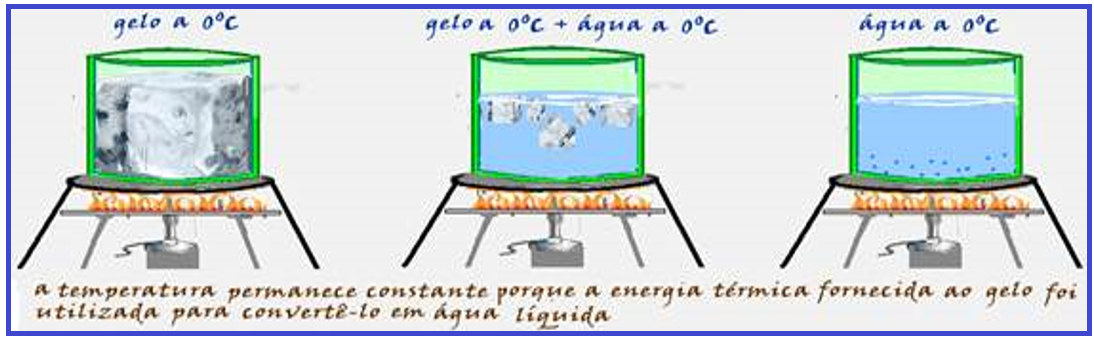
Nem sempre que um corpo recebe calor, sua temperatura aumenta.
Assim, por exemplo, aquecendo-se gelo a 0oC sob pressão normal e mexendo cuidadosamente a mistura até a fusão total do gelo, você não observa aumento de temperatura do conteúdo, que
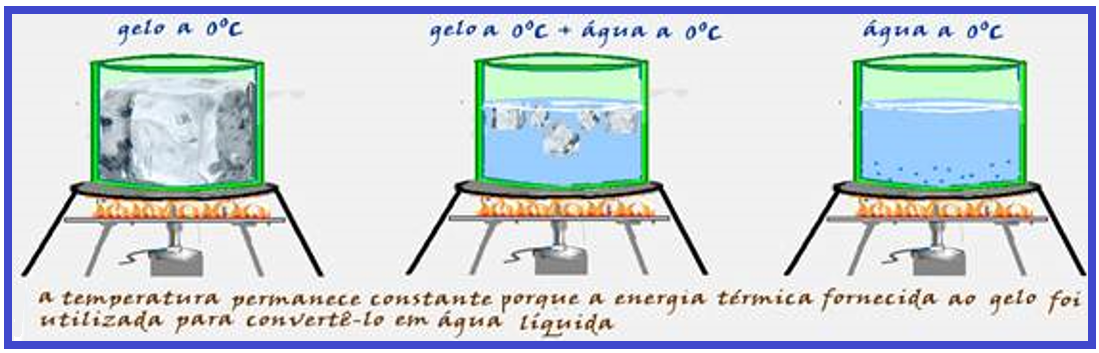
permanece durante toda a transformação sempre com a temperatura de 0oC.
Características da fusão
![]() Toda
substância, sob determinada pressão,
sofre fusão
(passagem
de sólido para líquido)
a uma dada
temperatura, correspondente à pressão considerada,
e que se denomina temperatura
de fusão da substância e
que ocorre quando a
substância recebe calor.
Toda
substância, sob determinada pressão,
sofre fusão
(passagem
de sólido para líquido)
a uma dada
temperatura, correspondente à pressão considerada,
e que se denomina temperatura
de fusão da substância e
que ocorre quando a
substância recebe calor.
 A
temperatura permanecerá constante durante toda a mudança de estado,
desde
que a pressão
permaneça constante.
A
temperatura permanecerá constante durante toda a mudança de estado,
desde
que a pressão
permaneça constante.
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
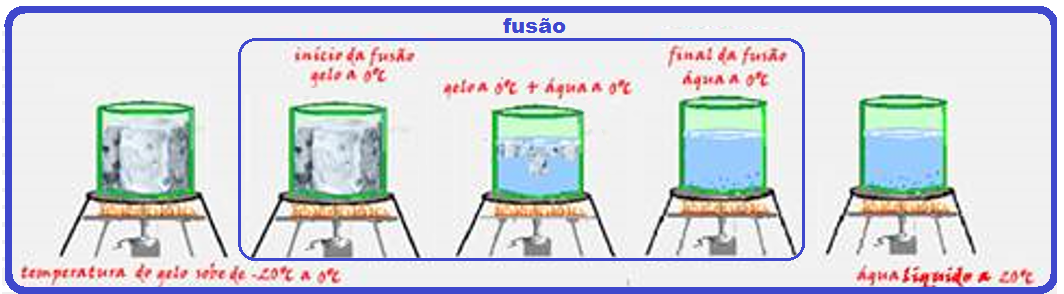
![]() Se
você tiver,
por exemplo, um pedaço
de gelo a -20oC
recebendo calor sob pressão normal, você
observa
que:
Se
você tiver,
por exemplo, um pedaço
de gelo a -20oC
recebendo calor sob pressão normal, você
observa
que:
Graficamente:

Comportamento das substâncias na fusão e na solidificação
![]() Algumas substâncias,
como a maior
parte dos líquidos e dos metais,
aumentam
de volume ao
se fundir
e
diminuem
de volume ao
se solidificar.
Algumas substâncias,
como a maior
parte dos líquidos e dos metais,
aumentam
de volume ao
se fundir
e
diminuem
de volume ao
se solidificar.
Outras substâncias (como a água) se comportam de maneira oposta.
![]() Devido ao fato de a
água aumentar
de volume ao se solidificar,
uma garrafa
cheia de água,
tampada,
se quebra quando a água em
seu interior
se solidifica e
um iceberg
flutua, pois seu volume aumenta, sua densidade fica menor que a da
água, ele fica mais leve que a mesma, flutuando.
Devido ao fato de a
água aumentar
de volume ao se solidificar,
uma garrafa
cheia de água,
tampada,
se quebra quando a água em
seu interior
se solidifica e
um iceberg
flutua, pois seu volume aumenta, sua densidade fica menor que a da
água, ele fica mais leve que a mesma, flutuando.
Gráfico da variação da pressão em função da temperatura de
fusão-solidificação para algumas substâncias e para a água
A temperatura de fusão ou de solidificação varia com a pressão.
Observe os gráficos abaixo e veja que, no caso da água (gráfico da direita) um aumento de pressão
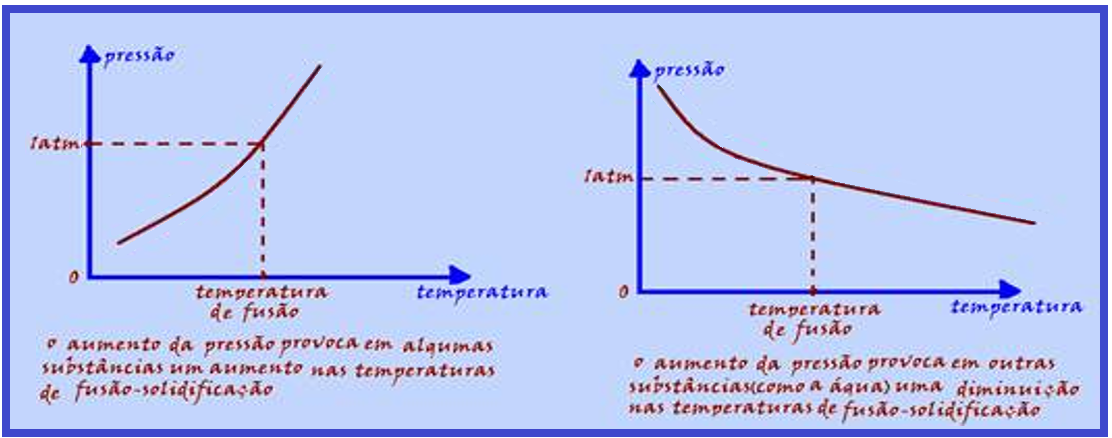
provoca uma diminuição de sua temperatura de fusão-solidificação e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas, fenômeno denominado regelo.
Regelo
Fenômeno pelo qual um aumento de pressão provoca uma diminuição da temperatura de fusão-solidificação da água e, devido à esse fato você consegue fundir o gelo mesmo que ele esteja a temperaturas abaixo de 0oC, submetendo-o à pressões elevadas.
Fenômenos que se pode explicar pelo regelo
![]() Experiência
de Tyndall
Experiência
de Tyndall
![]() quando você apoia
um arame fino com pesos nas extremidades, sobre
um bloco
de gelo, após
certo tempo o arame
atravessa o gelo e
a barra
continua inteira, pois
o aumento
da pressão provocado pelos pesos faz com que a
quando você apoia
um arame fino com pesos nas extremidades, sobre
um bloco
de gelo, após
certo tempo o arame
atravessa o gelo e
a barra
continua inteira, pois
o aumento
da pressão provocado pelos pesos faz com que a
temperatura de fusão do gelo diminua e o gelo abaixo do fio derreta.
Com o derretimento, o fio afunda lentamente e a água acima do mesmo volta a congelar, pois já não existe mais a pressão do fio.
![]() Ao comprimir
fortemente um
cubo
de gelo contra o outro você
verifica que eles
ficam “soldados”.
Ao comprimir
fortemente um
cubo
de gelo contra o outro você
verifica que eles
ficam “soldados”.

Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.


![]()

Características da vaporização e condensação (liquefação)
![]() Mantida
a pressão
constante, a vaporização (líquido em vapor) ou condensação
(vapor em líquido) ocorre à
temperatura
Mantida
a pressão
constante, a vaporização (líquido em vapor) ou condensação
(vapor em líquido) ocorre à
temperatura
constante, denominada temperatura de vaporização (àquela pressão).
![]()
Gráfico da variação da pressão em função da temperatura de
condensação-vaporização para algumas substâncias e para a água

A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão (veja gráfico) que mostra que, quando a pressão aumenta, a temperatura de vaporização também aumenta e se a pressão diminui, a temperatura de vaporização também diminui.
![]()

![]() Ao nível
do mar,
a água ferve
a 100oC.
No alto
de uma montanha,
onde a pressão
atmosférica é menor,
a
água
ferve a uma temperatura
Ao nível
do mar,
a água ferve
a 100oC.
No alto
de uma montanha,
onde a pressão
atmosférica é menor,
a
água
ferve a uma temperatura
 menor
que 100oC.
menor
que 100oC.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.

Tipos de vaporização
I. Evaporação: processo de vaporização que ocorre num grande intervalo de tempo, que se processa lenta e espontaneamente, independente da temperatura, e só acontece na superfície do líquido.
Ocorre com a superfície do líquido exposta ao meio ambiente de onde ele retira calor para se evaporar. Pode também retirar calor do meio com o qual está em contato. Veja casos nas figuras fornecidas:



Rapidez da evaporação
A rapidez com que a evaporação ocorre:
![]() É
inversamente
proporcional à pressão. Observe
nas figuras
abaixo que
a maior
pressão comprime mais as moléculas de
É
inversamente
proporcional à pressão. Observe
nas figuras
abaixo que
a maior
pressão comprime mais as moléculas de
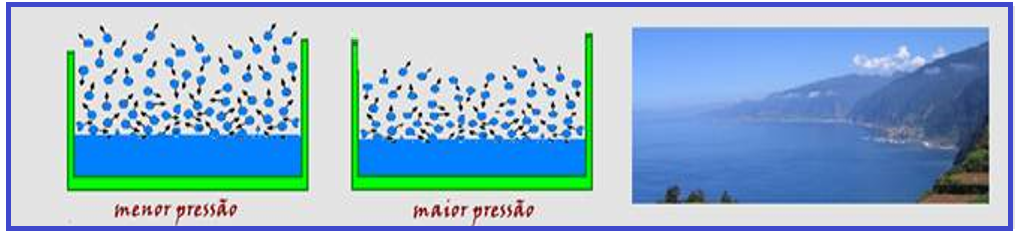
vapor evaporadas, dificultando sua saída da superfície líquida.
Portanto, a evaporação é mais rápida no alto da serra e mais lenta ao nível do mar.
 Depende
da natureza do líquido que está evaporando. Assim,
por
exemplo,
o éter
evapora mais
rapidamente
que a água; é mais volátil que ela.
Depende
da natureza do líquido que está evaporando. Assim,
por
exemplo,
o éter
evapora mais
rapidamente
que a água; é mais volátil que ela.
As moléculas do éter, do álcool (ou da gasolina) se atraem umas às outras menos fortemente que as da água, e sua camada superficial é mais fraca.
Por isso o éter, álcool (ou a gasolina) se evapora mais rapidamente que a água.
![]()
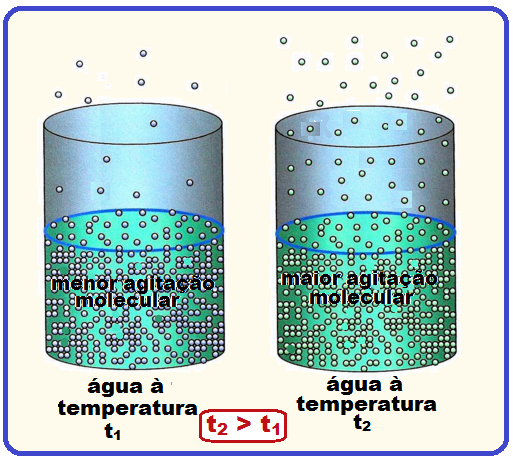
Depende da temperatura da substância que está evaporando.
Isso ocorre porque quanto maior a temperatura, maior é o movimento vibratório das moléculas do líquido, tendo assim, mais facilidade para escaparem da superfície líquida.
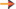

É diretamente proporcional à área da superfície de líquido exposta.
![]() Depende
da concentração de vapor de água (umidade do ar), junto ao
líquido.
Depende
da concentração de vapor de água (umidade do ar), junto ao
líquido.
II. Ebulição: processo rápido e violento de vaporização, que envolve todo o líquido com formação de bolhas no seu interior.

Exemplo: água fervendo.
III. Calefação: ocorre quando se coloca um líquido em contato com uma superfície de temperatura maior que a de ebulição do líquido.
Nesse
processo o líquido
gira rapidamente, adquire forma esférica, divide-se em esferas
menores que se movem rápida e desordenadamente, emitindo um som
característico. 
O líquido não entra em contato com a superfície aquecida.
Isso ocorre porque quando a camada inferior da gota evapora, as moléculas de água gasosa da camada não têm para onde escapar, assim que sua presença isola o resto da gota e impede que esta toque a superfície quente abaixo.
A gota, assim, permanece por alguns segundos, sem evaporar.
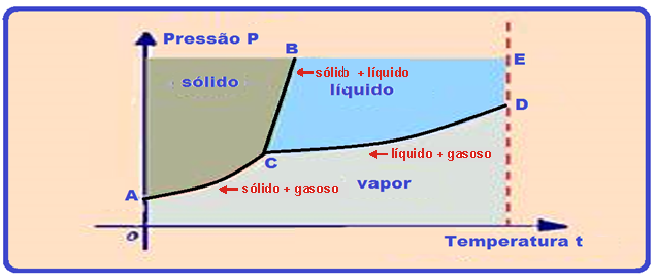
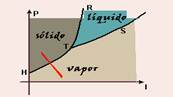
Diagrama de estado - ponto triplo
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases. Nele, para uma dada substância:
![]() Curva
CB
Curva
CB ![]() fornece a temperatura
e a pressão, de fusão ou solidificação
e essa curva
representa a curva de fusão onde os estados sólido e líquido estão
em equilíbrio ou seja, em qualquer ponto desta curva a substância
está em um estado de coexistência de estados sólido e líquido.
fornece a temperatura
e a pressão, de fusão ou solidificação
e essa curva
representa a curva de fusão onde os estados sólido e líquido estão
em equilíbrio ou seja, em qualquer ponto desta curva a substância
está em um estado de coexistência de estados sólido e líquido.
![]() Curva
CD
Curva
CD
![]() fornece
a temperatura e a pressão, de vaporização ou condensação
e essa curva
representa a curva de vaporização onde os estados líquido e vapor
estão em equilíbrio,
ou seja, em qualquer
ponto desta curva a substância está
em um estado de coexistência
de estados vapor e líquido.
fornece
a temperatura e a pressão, de vaporização ou condensação
e essa curva
representa a curva de vaporização onde os estados líquido e vapor
estão em equilíbrio,
ou seja, em qualquer
ponto desta curva a substância está
em um estado de coexistência
de estados vapor e líquido.
![]() Curva
AC
Curva
AC
![]() fornece
a temperatura e pressão, de sublimação ou cristalização e
essa curva representa a curva
de sublimação onde os estados sólido e vapor estão em equilíbrio,
ou seja, em qualquer ponto desta curva a substância está em um
estado de coexistência de estados sólido e vapor.
fornece
a temperatura e pressão, de sublimação ou cristalização e
essa curva representa a curva
de sublimação onde os estados sólido e vapor estão em equilíbrio,
ou seja, em qualquer ponto desta curva a substância está em um
estado de coexistência de estados sólido e vapor.

Temperatura Crítica
Thomas Andrews estabeleceu que: “Temperatura crítica é aquela acima da qual uma massa gasosa não pode mais sofrer liquefação, por maior que seja a pressão exercida”.
À pressão na qual a temperatura é crítica dá-se o nome de pressão crítica.
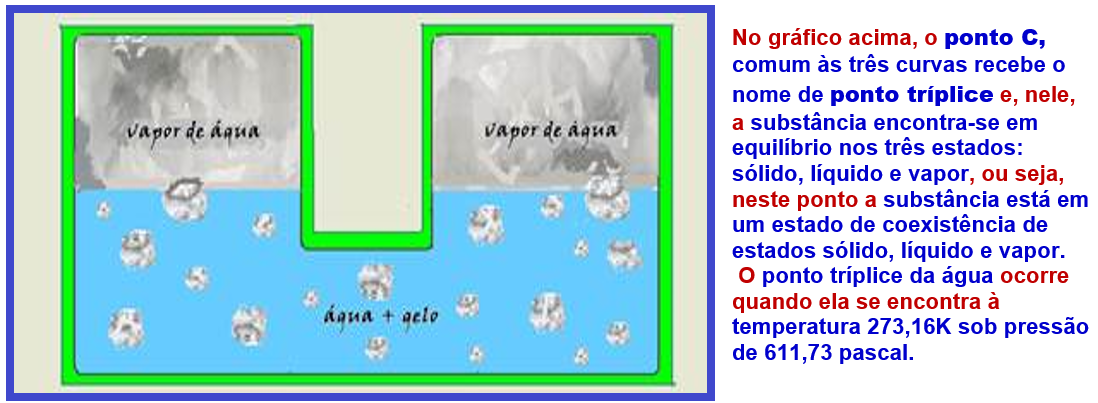
Veja, abaixo, um exemplo da aplicação do diagrama de fases:
Baseado no diagrama de fases você pode, por exemplo, efetuar a liquefação do vapor que se encontra no estado A por três processos:
Resfriá- lo sob pressão constante até atingir o estado líquido (trajeto AD) ou,
comprimi-lo à temperatura constante (trajeto AB) ou ainda resfriá-lo e comprimi-lo simultaneamente (trajeto AC)
O que você deve saber, informações e dicas
![]()
Mudanças de estado físico

![]()
A temperatura permanece constante durante tora mudança de estado, desde que a pressão permaneça constante.
Como a solidificação é o inverso da fusão, ela ocorre com liberação de calor, mas obedecendo às mesmas leis.
![]()

![]()

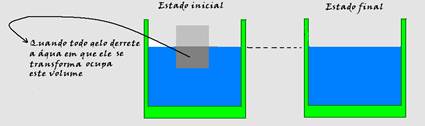
Um pedaço de gelo flutua em equilíbrio térmico com certa quantidade de água depositada em um balde.
À medida que o gelo derrete o nível da água no balde não se altera.
A densidade do gelo é menor que a densidade da água ou seja, o gelo ocupa mais espaço do que a quantidade de água equivalente.
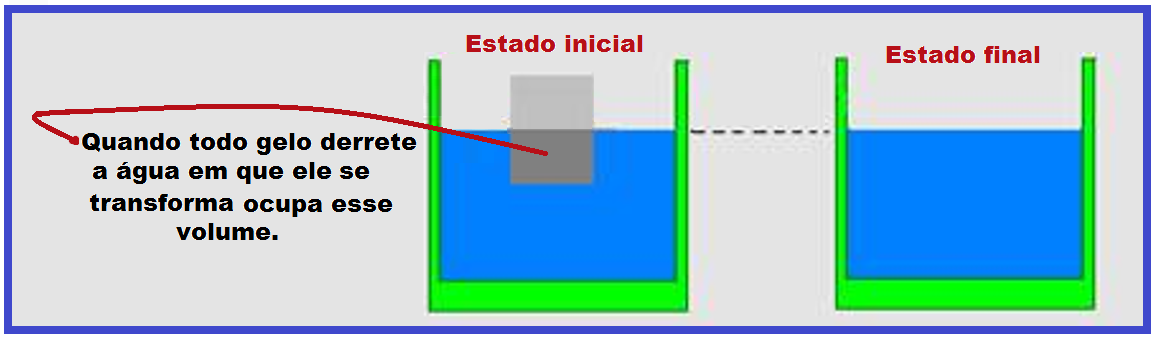
Assim, o volume de água proveniente do gelo derretido é igual ao volume de gelo que estava imerso. Por esse motivo, o nível da água no balde não se altera.
Observação: Baseado nisso, observe que o derretimento de um iceberg (que fica flutuando parcialmente imerso na água) não altera o nível do mar.
Mas, existe muito gelo sobre as montanhas e muito mais gelo sobre o continente do Polo Sul. É justamente este gelo que, ao derreter, escorre para o mar e contribui para o aumento do nível de água.
É possível comprovar esse fenômeno fisicamente: Como o gelo e a água se encontram em equilíbrio térmico, a temperatura de ambos é igual a 0ºC.
Sendo mG a massa de gelo, Vi o volume de gelo imerso e da a densidade da água, temos no equilíbrio de forças para o gelo flutuando que o empuxo E (vertical e para cima) deve ser igual ao peso P (vertical e para baixo).
P
= E
![]() mgelo.g
= da.g.Vi
mgelo.g
= da.g.Vi
![]() Vi
= mgelo/da
(I).
Vi
= mgelo/da
(I).
Quando
o gelo
derrete, ocupará um volume VA,
e lembrando que mgelo
=
mágua
![]() mgelo=
da.Va
(II)
mgelo=
da.Va
(II)
Substituindo
(II)
em (I)
![]() Vi
= da.Va
/da
Vi
= da.Va
/da
![]() Vi
=
Va.
Vi
=
Va.
Ou seja, o volume de água proveniente do gelo derretido (Va) é igual ao volume de gelo que estava imerso (Vi). Portanto, o nível da água no balde não se altera.
![]()
O diagrama abaixo representa a temperatura de uma substância inicialmente sólida em função do tempo, recebendo calor de uma fonte, sob pressão constante.
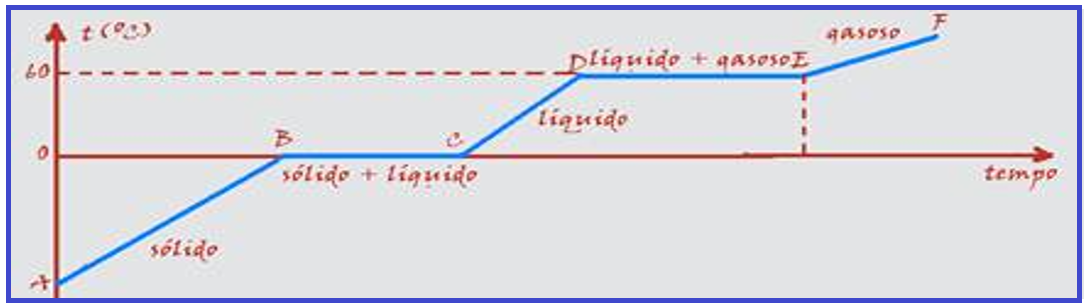
Observe que: no trecho AB ela se encontra no estado sólido; no trecho BC ela está mudando de estado e sua temperatura de fusão-solidificação é de 0oC; no trecho CD ela está no estado líquido; no trecho DE ela está mudando de estado e sua temperatura de vaporização-condensação é de 60oC e no trecho EF ela está no estado gasoso.
Observe também que não é a água, pois se vaporiza ou condensa a 60oC e não a 100oC.
![]()
Regelo
Quando sujeito a pressão maior que a normal, a temperatura de fusão do gelo diminui e ele se funde. Quando a pressão volta ao normal, o gelo se recompõe.
Veja na teoria alguns dos importantes fenômenos que podem ser explicados pelo regelo.
![]()
A temperatura de vaporização-liquefação da água e da maioria das substâncias aumenta conforme se aumenta a pressão.
![]()
Se determinada massa de água está se vaporizando, sob pressão normal, o fenômeno está ocorrendo a 100oC e, se você aumentar o tamanho da chama, a temperatura da água continuará sendo de 100oC, apenas a vaporização será mais rápida.
![]()
Ao nível do mar, a água ferve a 100oC. No alto de uma montanha, onde a pressão é menor, a água ferve a uma temperatura menor que 100oC.
No fundo de uma mina, a água ferverá a uma temperatura maior que 100oC.
![]()
Fraturas hidrotérmicas estão se abrindo no fundo do mar através das quais água muito quente é descarregada nos oceanos.
A água que emerge dessas fraturas a uma profundidade de 2400 m possui uma temperatura de 552 K.

Apesar dessa temperatura, a água não entra em ebulição por causa da alta pressão no fundo do oceano, pois, a medida que a pressão aumenta a temperatura de vaporização da água também aumenta.
![]()
A água pode ferver sem necessidade de aquecimento quando num recipiente aberto, no vácuo (pressão nula) ou em grandes altitudes, 27km, onde a pressão é muito baixa.
![]()

Nos dias frios, quando uma pessoa expele ar pela boca, forma-se uma espécie de "fumaça" junto ao rosto.
Isso
ocorre porque a pessoa
expele ar quente e úmido que se esfria, ocorrendo a condensação
dos vapores expelidos.
![]()
As curvas do gráfico recebem o nome de diagrama de estado ou diagrama de fases.
Nele, para uma dada substância:

![]() Curva
CB
Curva
CB
![]() fornece a
temperatura e a pressão, de fusão ou solidificação e essa curva
representa a curva de fusão onde os estados sólido e líquido estão
em equilíbrio.
fornece a
temperatura e a pressão, de fusão ou solidificação e essa curva
representa a curva de fusão onde os estados sólido e líquido estão
em equilíbrio.
![]() Curva
CD
Curva
CD
![]() fornece a
temperatura e a pressão, de vaporização ou condensação e essa
curva representa a curva de vaporização onde os estados líquido e
vapor estão em equilíbrio.
fornece a
temperatura e a pressão, de vaporização ou condensação e essa
curva representa a curva de vaporização onde os estados líquido e
vapor estão em equilíbrio.
![]() Curva
AC
Curva
AC ![]() fornece
a
temperatura e pressão, de sublimação ou cristalização e essa
curva representa a curva de sublimação onde os estados sólido e
vapor estão em equilíbrio.
fornece
a
temperatura e pressão, de sublimação ou cristalização e essa
curva representa a curva de sublimação onde os estados sólido e
vapor estão em equilíbrio.
Neste gráfico, o ponto C, comum às três curvas recebe o nome de ponto tríplice e, nele, a substância encontra-se em equilíbrio nos três estados: sólido, líquido e vapor.
Exercícios de vestibulares com resolução comentada sobre
Mudanças de estado físico da matéria
01-(UFPR)
Pode-se
atravessar uma barra de gelo usando-se uma arame com um peso
adequado, sem que a barra fique dividida em duas partes.
Qual
é a explicação para o fenômeno?
a) A pressão exercida pelo
arames obre o gelo abaixa seu ponto de fusão.
b) O gelo já
cortado pelo arame, devido a baixa temperatura, se funde
novamente.
c) A pressão exercida pelo arame sobre o gelo aumenta
seu ponto de fusão, mantendo a barra sempre solida.
d) O arame,
estando naturalmente mais aquecido, funde o gelo; essa energia, uma
vez perdida para a atmosfera, deixa a barra novamente solida.
e)
Há uma ligeira flexão da barra, e as duas partes, já cortadas pelo
arame, são comprimidas uma contra a outra, soldando-se.
02-(UFPEL-RS) Na
patinação sobre o gelo, o deslizamento é facilitado porque, quando
o patinador passa, parte do gelo se transforma em água, reduzindo o
atrito. Estando o gelo a uma temperatura inferior a 0ºC, isso ocorre
porque a pressão da lâmina do patim sobre o gelo faz com que ele
derreta.
De acordo com seus conhecimentos e com as informações do texto, é correto afirmar que a fusão do gelo acontece por que
a) a pressão não influencia no ponto de fusão.
b) o aumento da pressão aumenta o ponto de fusão.
c) a diminuição da pressão diminui o ponto de fusão.
d) a pressão e o ponto de fusão não se alteram.
e) o aumento da pressão diminui o ponto de fusão.
03-(FUVEST-SP)
Nos
dias frios, quando uma pessoa expele ar pela boca, forma-se uma
espécie de "fumaça" junto ao rosto. Isso ocorre porque a
pessoa:
a) expele ar quente que condensa o vapor de água
existente na atmosfera.
b) expele ar quente e úmido que se
esfria, ocorrendo a condensação dos vapores expelidos.
c) expele
ar frio que provoca a condensação do vapor de água na
atmosfera.
d) provoca a evaporação da água existente no ar.
e)
provoca a liquefação do ar, com seu calor.
04-(UFPEL-RS) Um bloco de chumbo está sendo fundido.

Durante esse processo, à pressão constante, é correto afirmar que
a) ele recebe calor e sua temperatura aumenta.
b) ele cede calor e sua temperatura aumenta.
c) ele recebe calor e sua temperatura permanece constante.
d) o calor evidenciado é sensível, pois há mudança de temperatura.
e) ele cede calor e sua temperatura diminui.
05- (UFPRL-RS) A panela de pressão é um recipiente que tem a finalidade de cozinhar os alimentos em menos tempo.
A quantidade de vapor contido dentro dela faz com que
a) aumente a pressão sobre a água, fazendo com que a sua temperatura de ebulição diminua.
b) aumente a pressão sobre a água, fazendo com que a sua temperatura de ebulição aumente.
c) diminua a pressão sobre a água, fazendo com que a sua temperatura de ebulição aumente.
d) aumente a pressão sobre a água, fazendo com que a sua temperatura de ebulição se mantenha constante e igual a 100 °C.
e) diminua a pressão sobre a água, fazendo com que a sua temperatura de ebulição permaneça constante e igual a 100 °C.
06-(UFPR)
A
água pode ser encontrada na natureza nos estados sólido, líquido
ou gasoso. Conforme as condições, a água pode passar de um
estado para outro através de processos que recebem nomes
específicos. Um desses casos é quando ela muda do estado gasoso
para o líquido.
Assinale a alternativa que apresenta o nome correto dessa transformação.
a) Sublimação.
b) Vaporização.
C) Solidificação.
d) Condensação.
e) Fusão.
07-(UNESP-SP) Nos quadrinhos da tira, a mãe menciona as fases da água conforme a mudança das estações.

Entendendo "boneco de neve" como sendo "boneco de gelo" e que com o termo "evaporou" a mãe se refira à transição água e vapor, pode-se supor que ela imaginou a sequência gelo e água e vapor e água.
As mudanças de estado que ocorrem nessa sequência são
a) fusão, sublimação e condensação.
b) fusão, vaporização e condensação.
c) sublimação, vaporização e condensação.
d) condensação, vaporização e fusão.
e) fusão, vaporização e sublimação.
08- (UFRS-RS) Põem-se 20g de gelo fundente em um copo com água. Põem-se 20g de água a 0oC em outro copo com igual quantidade de água à mesma temperatura. Então:
a) o primeiro copo esfria mais
b) o segundo copo esfria mais
c) os dois copos esfriam por igual
d) os dois copos mantêm a temperatura constante
09-(PUC-SP) Um recipiente contém água inicialmente à temperatura e pressão ambientes. Para que essa água entre em ebulição deve-se:
a) aumentar a pressão e diminuir a temperatura
b) baixar a pressão e a temperatura
c) baixar a temperatura e manter a pressão
d) aumentar a pressão e a temperatura
e) baixar a pressão se for mantida a temperatura
10-(UERJ-RJ) Na evaporação de um líquido:
a) a velocidade é maior em ambiente saturado.
b) a velocidade não depende da pressão de vapor do líquido no ambiente em que ele se processa.
c) a velocidade é constante, mesmo em ambiente fechado.
d) a velocidade não depende da temperatura.
e) a velocidade é proporcional à área da superfície livre do líquido
11-(PUC-SP) A maior velocidade de evaporação do álcool, quando comparada com a da água, mostra que a evaporação depende da:
a) temperatura
b) área de superfície livre
c) pressão do ar
d) pressão
e) natureza do líquido
12-(PUC-SP) Um cilindro dotado de êmbolo contém certo líquido em equilíbrio com seu próprio vapor. Se reduzirmos o volume

V (veja a figura), sem alterar a temperatura:
a) mais líquido se vaporiza.
b) mais vapor se condensa.
c) a proporção líquido e vapor não se altera.
d) o líquido ferve
e) o líquido se solidifica.
13-(PUC-MG) Na questão a seguir assinale a afirmativa INCORRETA.
a) Todos os materiais expandem-se quando aquecidos.
b) A temperatura de fusão de uma substância depende da pressão.
c) Durante uma mudança de fase, a temperatura permanece constante.
d) A temperatura em que a água ferve depende da pressão.
14-(ENEM-MEC) O esquema da panela de pressão e um diagrama de fase da água são apresentados a seguir.
A
vantagem do uso de panela de pressão é a rapidez para o cozimento
de alimentos e isto se deve
a) à pressão no seu interior, que é igual à pressão externa.
b) à temperatura de seu interior, que está acima da temperatura de ebulição da água no local.
c) à quantidade de calor adicional que é transferida à panela.
d) à quantidade de vapor que está sendo liberada pela válvula.
e) à espessura da sua parede, que é maior que a das panelas comuns.
15- (ENEM-MEC)
Se,
por economia, abaixarmos o fogo sob uma panela de pressão logo que
se inicia a saída de vapor pela válvula, de forma simplesmente a
manter a fervura, o tempo de cozimento
a) será maior porque a panela "esfria".
b) será menor, pois diminui a perda de água.
c) será maior, pois a pressão diminui.
d) será maior, pois a evaporação diminui.
e) não será alterado, pois a temperatura não varia.
16-(ENEM-MEC)
Nas discussões sobre a existência de vida fora da Terra, Marte tem
sido um forte candidato a hospedar vida. 
No entanto, há ainda uma enorme variação de critérios e considerações sobre a habitabilidade de Marte, especialmente no que diz respeito à existência ou não de água líquida.
Alguns dados comparativos entre a Terra e Marte estão apresentados na tabela.

Com base nesses dados, é possível afirmar que, dentre os fatores abaixo, aquele mais adverso à existência de água líquida em Marte é sua
a) grande distância ao Sol.
b) massa pequena.
c) aceleração da gravidade pequena.
d) atmosfera rica em CO.
e) temperatura média muito baixa.
17- (UFC-CE) Ao nível do mar, a água ferve a 100°C e congela a 0°C. Assinale a alternativa que indica o ponto de congelamento e o ponto de fervura da água, em Guaramiranga (CE), cidade localizada a cerca de 1.000 m de altitude.





a) A água congela abaixo de 0°C e ferve acima de 100°C.
b) A água congela acima de 0°C e ferve acima de 100°C.
c) A água congela abaixo de 0°C e ferve abaixo de 100°C.
d) A água congela acima de 0°C e ferve abaixo de 100°C.
e) A água congela a 0°C e ferve a 100°C.
18- (UFSM-RS) Assinale falsa (F) ou verdadeira (V) em cada afirmativa.
( ) A água pode evaporar a uma temperatura menor do que 100°C.
( ) A sensação de frio ocasionada pela evaporação da água sobre a pele deve-se à absorção de energia da pele pelo líquido.
( ) A velocidade de evaporação da água não depende da pressão externa.
A sequência correta é
![]()
19-(UEG-GO) Fraturas hidrotérmicas estão se abrindo no fundo do mar através das quais água muito quente é descarregada nos oceanos. A água que emerge dessas fraturas a uma profundidade de 2400 m possui uma temperatura de 552 K.


Apesar dessa temperatura, a água não entra em ebulição por causa
a) da baixa temperatura das águas profundas dos oceanos.
b) da alta pressão no fundo do oceano.
c) do pequeno volume de água quente.
d) da transferência isotérmica de calor.
20-(CPS-SP)
Uma
pessoa solicita numa lanchonete um hambúrguer e um copo de
refrigerante com cubos de gelo. A temperatura dos cubos de gelo e o
refrigerante são iguais. Não existindo perdas de calor durante a
fusão do gelo no refrigerante, o fenômeno físico
que se observa no sistema (refrigerante + gelo) indica que
a) a temperatura do sistema mantém-se constante durante a fusão do gelo.
b) a temperatura do sistema aumenta.
c) a temperatura do sistema diminui.
d) a temperatura do gelo mantém-se constante e do refrigerante aumenta.
e) a temperatura do sistema sempre aumenta.
21-(CPS-SP) Os efeitos do aquecimento global no Oceano Ártico, no Pólo Norte, podem ser irreversíveis, afirma pesquisa divulgada pela Academia Nacional de Ciências dos Estados Unidos. As mudanças climáticas ocorridas nos últimos anos reduziram parte da


camada de gelo que cobre o Ártico, aumentaram a duração dos dias, alteraram o desenvolvimento de organismos como algas e larvas e criaram novos habitats.
Os polos são os primeiros locais do planeta a serem atingidos pelos efeitos das mudanças climáticas globais.
Um bloco de gelo recebe uma quantidade de calor, realizando uma mudança do estado sólido para o estado líquido. Pode-se observar, durante este fenômeno, que a temperatura do gelo:
a) aumenta gradativamente independente de sua massa.
b) diminui gradativamente independente de sua massa.
c) permanece constante independente de sua massa.
d) varia diretamente com sua massa.
e) varia inversamente com sua massa.
22-(CFT-MG)
Uma
panela com um litro de água é colocada sobre a chama de um fogão.
A temperatura de ebulição dessa água irá depender da
a) capacidade térmica da panela.
b) pressão atmosférica ambiente.
c) condutividade térmica da panela.
d) quantidade de calor cedida pela chama.
23-(UNESP-SP) Considere seus conhecimentos sobre mudanças de fase e analise as afirmações I, II e III, referentes à substância água, um recurso natural de alto valor.
I. Durante a transição de sólido para líquido, a temperatura não muda, embora uma quantidade de calor tenha sido fornecida à água.
II. O calor latente de condensação da água tem um valor diferente do calor latente de vaporização.
III. Em determinadas condições, a água pode coexistir na fase sólida, líquida e gasosa.
Pode-se afirmar que
a) apenas a afirmação I é correta.
b) apenas as afirmações I e II são corretas.
c) apenas as afirmações I e III são corretas.
d) apenas as afirmações II e III são corretas.
e) as afirmações I, II e III são corretas.
24-(UFSC-SC) Assinale a(s) proposição(ões) CORRETA(S) em relação a alguns fenômenos que envolvem os conceitos de temperatura, calor, mudança de estado e dilatação térmica.
(01) A temperatura de um corpo é uma grandeza física relacionada à densidade do corpo.
(02) Uma substância pura ao receber calor ficará submetida a variações de temperatura durante a fusão e a ebulição.
(04) A dilatação térmica é um fenômeno específico dos líquidos, não ocorrendo com os sólidos.
(08) Calor é uma forma de energia.
(16) O calor se propaga no vácuo.
25-(CFT-SC) Um pedaço de gelo flutua em equilíbrio térmico com certa quantidade de água depositada em um balde. Podemos afirmar que, à medida que o gelo derrete:
a) o nível da água no balde aumenta, pois haverá uma queda de temperatura da água.
b) o nível da água no balde diminui, pois haverá uma queda de temperatura da água.
c) o nível da água no balde aumenta, pois a densidade da água é maior que a densidade do gelo.
d) o nível da água no balde diminui, pois a densidade da água é maior que a densidade do gelo.
e) o nível da água no balde não se altera.
26-(PUC-RS)
Considere as informações a seguir e preencha os parênteses com V
(verdadeiro) e F (falso).
Uma panela de pressão cozinha alimentos em água em um tempo menor do que as panelas comuns. Esse desempenho da panela
de pressão se deve à:
( ) influência da pressão sobre a temperatura de ebulição da água.
( ) maior espessura das paredes e ao maior volume interno da panela de pressão.
( ) temperatura de ebulição da água, que é menor do que 100°C, neste caso.
( ) pressão interna, de uma atmosfera (1 atm), mantida pela válvula da panela de pressão.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é:
a) V - F - F – F
b) V - V - F – V
c) F - F - V – V
d) F - V - V – V
e) V - V - F – F
27-(UFSM-RS)
No
atendimento médico de um jogador, é colocado éter no local
machucado, para provocar uma redução da temperatura. Considerando
esse fato, analise as afirmações:
I - Parte da energia usada na evaporação do éter vem do lugar machucado.
II - De um modo geral, a evaporação ocorre a qualquer temperatura.
III - A redução da temperatura no local machucado independe da quantidade de éter colocado.
Está(ão) CORRETA(S)
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas I e II.
e) apenas II e III.
28-(UFF-RJ) Um dos mais intrigantes fenômenos naturais é a mudança de fase que ocorre, por exemplo, quando a água líquida se vaporiza, ao ferver. Mede-se a temperatura da água fervente em duas panelas, uma de barro e outra metálica.
Ambas
se encontram sobre fogões de cozinha, um deles no nível do mar e o
outro no alto do Pico da Bandeira.
A temperatura da água fervente
a) é sempre 100 °C, portanto é a mesma em ambas as panelas.
b) é menor na panela onde começou a ferver há menos tempo.
c) é menor na panela que se encontra no Pico da Bandeira.
d) é menor na panela metálica.
e) é menor na panela de barro.
29-(PUC-RS) A água apresenta um comportamento incomum entre 0 e 4ºC: nesse intervalo de temperatura, enquanto a temperatura diminui, a água se expande, ao contrário do que acontece, em geral, com outras substâncias.
Esse comportamento permite a sobrevivência da fauna e flora aquáticas durante o inverno. No gráfico que segue, o volume da substância água é relacionado com a sua temperatura em graus celsius 0C).
A
propósito das informações anteriores, afirma-se:
I. Em temperatura ambiente acima de 4ºC, a água no fundo do lago apresentará temperatura mais baixa do que a da superfície.
II. Em temperatura ambiente inferior a 0ºC, a água ficará congelada na superfície e líquida em profundidades maiores, pois o gelo da superfície isola termicamente as águas mais profundas.
III. Em qualquer temperatura ambiente, a temperatura da água será a mesma em todas as profundidades.
A(s) afirmativa(s) correta(s) é/são, apenas,
![]()
30-(UEM-PR) Analise as seguintes afirmativas:
I. Em uma panela de pressão, a água pode atingir uma temperatura superior a 100 ºC, sem entrar em ebulição.
II. Uma garrafa cheia de cerveja pode estourar quando colocada em um congelador, pois a água da cerveja aumenta de volume ao se solidificar.
III. Em uma panela comum, a água pode entrar em ebulição a uma temperatura menor que 100 ºC, desde que o experimento seja feito em um local onde a pressão atmosférica seja menor que 1 atm.
IV. O aumento na pressão provoca uma diminuição na temperatura de fusão das substâncias.
Dessas afirmativas, estão corretas
![]()
31-(PUC-MG) Ao prepararmos os alimentos, é comum aquecermos a água em recipientes abertos. Nesses recipientes, a água entra em ebulição quando sua pressão de vapor se iguala à pressão atmosférica.




Considerando-se as informações dadas, pode-se afirmar que a temperatura de ebulição da água será:
a) maior em Belo Horizonte.
b) menor em Guarapari.
c) a mesma nas três localidades, desde que consideremos H2O puro.
d) menor no Pico da Bandeira.
32-(UNESP) Considere seus conhecimentos sobre mudanças de fase e analise as afirmações I, II e III, referentes à substância água, um recurso natural de alto valor.
I. Durante a transição de sólido para líquido, a temperatura não muda, embora uma quantidade de calor tenha sido fornecida à água.
II. O calor latente de condensação da água tem um valor diferente do calor latente de vaporização.
III. Em determinadas condições, a água pode coexistir na fase sólida, líquida e gasosa.
Pode-se afirmar que
a) apenas a afirmação I é correta.
b) apenas as afirmações I e II são corretas.
c) apenas as afirmações I e III são corretas.
d) apenas as afirmações II e III são corretas.
e) as afirmações I, II e III são corretas.
33-(UEM-PR)
Ao
se colocar uma bola de naftalina em uma gaveta, sabe-se que ela passa
para o estado de vapor sem passar pelo estado líquido. Esse é um
processo de
a) evaporação.
b) sublimação.
c) fusão.
d) fissão.
e) condensação.
34-(ENEM-MEC) A Constelação Vulpécula (Raposa) encontra-se a 63 anos-luz da Terra, fora do sistema solar. Ali, o planeta gigante HD 189733b, 15% maior que Júpiter, concentra vapor de água na atmosfera. A temperatura do vapor atinge 900 graus Celsius. “A água sempre está lá, de alguma forma, mas às vezes é possível que seja escondida por outros tipos de nuvens”, afirmaram os astrônomos do Spitzer Science Center (SSC), com sede em Pasadena, Califórnia, responsável pela descoberta. A água foi detectada pelo espectrógrafo infravermelho, um aparelho do telescópio espacial Spitzer.
Correio Braziliense, 11 dez. 2008 (adaptado).
De
acordo com o texto, o planeta concentra vapor de água em sua
atmosfera a 900 graus Celsius. Sobre a vaporização infere-se que
a) se há vapor de água no planeta, é certo que existe água no estado líquido também.
b) a temperatura de ebulição da água independe da pressão, em um local elevado ou ao nível do mar, ela ferve sempre a 100 graus Celsius.
c) o calor de vaporização da água é o calor necessário para fazer 1 kg de água líquida se transformar em 1 kg de vapor de água a 100 graus Celsius.
d) um líquido pode ser superaquecido acima de sua temperatura de ebulição normal, mas de forma nenhuma nesse líquido haverá formação de bolhas.
e) a água em uma panela pode atingir a temperatura de ebulição em alguns minutos, e é necessário muito menos tempo para fazer a água vaporizar completamente.
35-(PUC-PR) O granizo é a precipitação sólida de grânulos de gelo, transparentes ou translúcidos, de forma esférica ou irregular, raramente cônica, de diâmetro igual ou superior a 5 mm.
O granizo é formado nas nuvens do tipo "cumulonimbus", as quais se desenvolvem verticalmente, podendo atingir alturas de até 1.600 m. Em seu interior ocorrem intensas correntes ascendentes e descendentes. As gotas de chuva provenientes do vapor condensado no interior dessas nuvens, ao ascenderem sob o efeito das correntes verticais, congelam-se assim que atingem as regiões mais elevadas.




O granizo causa grandes prejuízos à agricultura. No Brasil, as culturas de frutas de clima temperado, como uva, maçã, pera, pêssego, kiwi, são as mais vulneráveis ao granizo, quando ocorre o desfolhamento total das plantas com ferimentos severos nos frutos.
Dentre os danos materiais provocados pela chuva de granizo está a destruição de telhados, especialmente quando construídos com telhas de amianto.
As cooperativas de fruticultores podem realizar parcerias com as instituições de meteorologia e adquirir foguetes para bombardearem as nuvens de granizo com substâncias higroscópicas (iodeto de prata), com o objetivo de provocar a precipitação da chuva e evitar a formação de granizo.
Com base no texto, assinale a alternativa CORRETA.
a) A formação de nuvens cumulonimbus ocorre como consequência da corrente de convecção, quando a ascensão de ar frio determina o seu resfriamento e as consequentes condensações e precipitações.
b) O granizo, em seu processo de formação, envolve a sublimação, pelo resfriamento, do excesso de H2O em estado líquido.
c) O granizo é um tipo de precipitação atmosférica na qual as gotas de água evaporam, quando levadas para camadas mais frias e mais altas, e crescem gradativamente até atingir tamanho e peso capazes de romper a força de empuxo. Essa ação pode causar grandes danos econômicos e sociais.
d) O iodeto de prata é uma substância higroscópica (absorve umidade) que acaba provocando no granizo vaporização.
e) Ocorre um instante em que a resultante das forças no granizo é diferente de zero e em direção e sentido à terra, iniciando o movimento de queda.
36-(ENEM-MEC)
Ainda
hoje, é muito comum as pessoas utilizarem vasilhames de barro
(moringas ou potes de cerâmica não esmaltada) para conservar água
a uma temperatura menor do que a do ambiente. Isso ocorre porque:
a)
o barro isola a água do ambiente, mantendo-a sempre a uma
temperatura menor que a dele, como se fosse isopor.
b) o barro tem
poder de “gelar” a água pela sua composição química. Na
reação, a água perde calor.
c) o barro é poroso, permitindo
que a água passe através dele. Parte dessa água evapora, tomando
calor da moringa e do restante da água, que são assim
resfriadas.
d) o barro é poroso, permitindo que a água se
deposite na parte de fora da moringa. A água de fora sempre está a
uma temperatura maior que a de dentro.
e) a moringa é uma espécie
de geladeira natural, liberando substâncias higroscópicas que
diminuem naturalmente a temperatura da água.
37-(ENEM-MEC) O Sol participa do ciclo da água, pois, além de aquecer a superfície da Terra dando origem aos ventos, provoca a evaporação da água dos rios, lagos e mares. O vapor da água, ao se

resfriar, condensa-se em minúsculas gotinhas, que se agrupam formando as nuvens, neblinas ou névoas úmidas. As nuvens podem ser levadas pelos ventos de uma região para outra. Com a condensação e, em seguida, a chuva, a água volta à superfície da Terra, caindo sobre o solo, rios, lagos e mares. Parte dessa água evapora retornando à atmosfera, outra parte escoa superficialmente ou infiltra-se no solo, indo alimentar rios e lagos. Esse processo é chamado de ciclo da água.
Considere, então, as seguintes afirmativas:
I.
A evaporação é maior nos continentes, uma vez que o aquecimento
ali é maior do que nos oceanos.
II. A vegetação participa
do ciclo hidrológico por meio da transpiração.
III. O
ciclo hidrológico condiciona processos que ocorrem na litosfera, na
atmosfera e na biosfera.
IV. A energia gravitacional
movimenta a água dentro do seu ciclo.
V. O ciclo
hidrológico é passível de sofrer interferência humana, podendo
apresentar desequilíbrios.
Analisando as afirmativas, você pode concluir que:
(A)
somente a afirmativa III está correta.
(B) somente as
afirmativas III e IV estão corretas.
(C) somente as
afirmativas I, II e V estão corretas.
(D) somente as
afirmativas II, III, IV e V estão corretas.
(E) todas as
afirmativas estão corretas.
38-
(UEM-PR) O gráfico abaixo ilustra o comportamento dos dados obtidos
no aquecimento de uma certa quantidade de gelo.
Analisando a variação da temperatura em relação à variação na quantidade de calor, assinale a alternativa correta.
a) No trecho AB, o gelo está mudando de fase.
b) No trecho BC, o gelo está em repouso.
c) No trecho CD, ocorre uma liberação de calor latente.
d) No trecho DE, há uma mudança de fase.
e) No trecho EF, o gelo está derretendo.
39-(UNESP) Considere o diagrama para uma determinada substância.
Sabendo-se
que a transformação ocorre no sentido de A para D, pode-se afirmar
que no trecho
a) AB a substância está na fase líquida.
b) BC está ocorrendo fusão ou vaporização.
c) CD há apenas vapor.
d) BC há uma mistura de líquido e vapor.
e) CD está ocorrendo transição de fase.
40-(PUCCAMP-SP) O diagrama de estado físico para certa substância está representado a seguir.
A
mudança de estado físico denominada sublimação pode ocorrer
a) somente no ponto H.
b) somente no ponto T.
c) em pontos da curva HT.
d) em pontos da curva TR.
e) em pontos da curva TS.
41-(UNICAMP-SP) No Rio de Janeiro (ao nível do mar), uma certa quantidade de feijão demora 40 minutos em água fervente para ficar pronta.

A
tabela abaixo fornece o valor da temperatura de fervura da água em
função da pressão atmosférica, enquanto o gráfico fornece o
tempo de cozimento dessa quantidade de feijão em função da
temperatura. A pressão atmosférica ao nível do mar vale 760 mmHg e
ela diminui 10 mmHg para cada 100 m de
altitude.
Temperatura
de fervura da água em função da pressão

Tempo de cozimento
versus temperatura

a)
Se o feijão fosse colocado em uma panela de pressão a 880 mmHg, em
quanto tempo ele ficaria pronto?
b) Em uma panela aberta, em
quanto tempo o feijão ficará pronto na cidade de Gramado (RS) na
altitude de 800 m?
c) Em que altitude o tempo de cozimento do
feijão (em uma panela aberta) será o dobro do tempo de cozimento ao
nível do mar?
42-(UEL-PR)
Nas
condições usualmente encontradas no ambiente em que vivemos, a
matéria assume três estados: sólido, líquido e gasoso. A água,
por exemplo, pode ser encontrada em qualquer desses estados de acordo
com a pressão e temperatura do ambiente. Nosso domínio sobre o
ambiente decorre, entre outras coisas, do fato de que sabemos
controlar as mudanças entre esses estados. De maneira geral, fusão
é a transformação que leva uma substância do estado sólido para
o estado líquido. Vaporização é a transformação que leva uma
substância do estado líquido para o estado gasoso. Sublimação é
a transformação que leva uma substância diretamente do estado
sólido para o estado gasoso. O diagrama de fases reune em um
diagrama de pressão x temperatura, as curvas de fusão, de
vaporização e de sublimação de uma dada substância, conforme a
figura a seguir. Com base no diagrama e nos conhecimentos sobre o
tema, é correto afirmar:
a) Na região I, a substância está no estado gasoso. Na região II, a substância está no estado líquido. Na região III, a substância está no estado sólido. No ponto 1, a substância está em um estado de coexistência de estados sólido e gasoso. No ponto 2, a substância está em um estado de coexistência de estados líquido e gasoso. No ponto 3, a substância está em um estado de coexistência de estados líquido e sólido.
b) Na região I, a substância está no estado líquido. Na região II, a substância está no estado gasoso. Na região III a substância está no estado sólido. No ponto 1 a substância está num estado de coexistência de estados sólido e líquido. No ponto 2 a substância está num estado de coexistência de estados líquido e gasoso. No ponto 3 a substância está num estado de coexistência de estados sólido e gasoso.
c) Na região I a substância está no estado gasoso. Na região II a substância está no estado sólido. Na região III, a substância está no estado líquido. No ponto 1, a substância está em um estado de coexistência de estados líquido e gasoso. No ponto 2, a substância está em um estado de coexistência de estados sólido e gasoso. No ponto 3, a substância está em um estado de coexistência de estados líquido e sólido.
d) Na região I, a substância está no estado sólido. Na região II, a substância está no estado líquido. Na região III, a substância está no estado gasoso. No ponto 1, a substância está em um estado de coexistência de estados sólido e gasoso. No ponto 2, a substância está em um estado de coexistência de estados sólido e líquido. No ponto 3, a substância está em um estado de coexistência de estados líquido e gasoso.
e) Na região I, a substância está no estado líquido. Na região II, a substância está no estado sólido. Na região III, a substância está no estado gasoso. No ponto 1, a substância está em um estado de coexistência de estados líquido e gasoso. No ponto 2, a substância está em um estado de coexistência de estados sólido e líquido. No ponto 3, a substância está em um estado de coexistência de estados sólido e gasoso.
43-(UFMS-MS) Uma cozinheira resolve ferver água em uma panela de pressão, para atingir maior temperatura que em panelas abertas. Para isso, coloca água no seu interior, onde todo o sistema, panela e água, está em equilíbrio térmico com o ambiente na temperatura TA e pressão atmosférica PA. Em seguida, fecha a panela e coloca-a sobre a chama de um fogão. A água, no interior da panela, vai aumentando a pressão e a temperatura e, após um certo tempo entra em ebulição liberando vapor para o ambiente pela válvula. As figuras abaixo representam diagramas da pressão P x temperatura T da água, onde as linhas mais finas definem as regiões, de temperatura e pressão em que a água pode se apresentar em cada um dos possíveis estados, sólido (S), líquido (L) e vapor (V). Já as linhas mais grossas (negrito) representam processos termodinâmicos.
Assinale qual dos diagramas representa corretamente o processo termodinâmico que a água, no interior da panela, sofreu desde o instante em que começou a ser aquecida, quando estava à temperatura TA e Pressão PA, até o momento em que entra em ebulição à temperatura TB e Pressão PB.

44- (UNIFESP-SP) A sonda Phoenix, lançada pela NASA, detectou em 2008 uma camada de gelo no fundo de uma cratera na superfície de Marte. Nesse planeta, o gelo desaparece nas estações quentes

e reaparece nas estações frias, mas a água nunca foi observada na fase líquida. Com auxílio do diagrama de fase da água, analise as três afirmações seguintes.
I
- O desaparecimento e o reaparecimento do gelo, sem a presença da
fase líquida, sugerem a ocorrência de sublimação.
II - Se o gelo sofre sublimação, a pressão atmosférica local deve ser muito pequena, inferior à pressão do ponto triplo da água.
III - O gelo não sofre fusão porque a temperatura no interior da cratera não ultrapassa a temperatura do ponto triplo da água.
De acordo com o texto e com o diagrama de fases, pode-se afirmar que está correto o contido em:
a) I, II e III.
b) II e III, apenas.
c) I e III, apenas.
d) I e II, apenas.
e) I, apenas.
45-(UFMG-MG) Considere estas informações:
• a temperaturas muito baixas, a água está sempre na fase sólida;
• aumentando-se a pressão, a temperatura de fusão da água diminui.
Assinale a alternativa em que o diagrama de fases pressão versus temperatura para a água está de acordo com essas informações.

46-(UEG-GO) Foi realizado o seguinte experimento em uma aula de Laboratório de Física:
Uma jarra de vidro aberta foi aquecida até que a água no seu interior fervesse.
Cessando-se
o aquecimento, a água parou de ferver. Posteriormente, a jarra foi
tampada e em cima dela despejou-se água à temperatura ambiente.
Então, observou-se que a água voltou a ferver.
Sobre esse experimento, responda ao que se pede.
a) Justifique o motivo que levou a água a voltar a ferver.
b) Se esse mesmo experimento fosse realizado a uma altitude superior em relação ao anterior, a temperatura de ebulição da água aumentaria, diminuiria ou permaneceria constante? Justifique.
47-(PUC-MG) Quando aquecemos água em nossas casas utilizando um recipiente aberto, sua temperatura nunca ultrapassa os 100 ºC. Isso ocorre porque:

a) ao atingir essa temperatura, a água perde sua capacidade de absorver calor.
b) ao atingir essa temperatura, a água passa a perder exatamente a mesma quantidade de calor que está recebendo, mantendo assim sua temperatura constante.
c) as mudanças de fase ocorrem à temperatura constante.
d) ao atingir essa temperatura, a água começa a expelir o oxigênio e outros gases nela dissolvidos.
48-(UFF-RJ) Uma
bola de ferro e uma bola de madeira, ambas com a mesma massa e a
mesma temperatura, são retiradas de um forno quente e colocadas
sobre blocos de gelo.
Marque a opção que descreve o que acontece a seguir.
a) A bola de metal esfria mais rápido e derrete mais gelo.
b) A bola de madeira esfria mais rápido e derrete menos gelo.
c) A bola de metal esfria mais rápido e derrete menos gelo.
d) A bola de metal esfria mais rápido e ambas derretem a mesma quantidade de gelo.
e) Ambas levam o mesmo tempo para esfriar e derretem a mesma quantidade de gelo.
49-(ENEM-MEC) Sob pressão normal (ao nível do mar), a água entra em ebulição à temperatura de 100°C. Tendo por base essa informação, um garoto residente em uma cidade litorânea fez a seguinte experiência:
•
Colocou uma caneca metálica
contendo água no fogareiro do fogão de sua casa.
• Quando a água começou a ferver, encostou cuidadosamente a extremidade mais estreita de uma seringa de injeção, desprovida de agulha, na superfície do líquido e, erguendo o êmbolo da seringa, aspirou certa quantidade de água para seu interior, tapando-a em seguida.
• Verificando após alguns instantes que a água da seringa havia parado de ferver, ele ergueu o êmbolo da seringa, constatando, intrigado, que a água voltou a ferver após um pequeno deslocamento do êmbolo.
Considerando o procedimento anterior, a água volta a ferver porque esse deslocamento
a) permite a entrada de calor do ambiente externo para o interior da seringa.
b) provoca, por atrito, um aquecimento da água contida na seringa.
c) produz um aumento de volume que aumenta o ponto de ebulição da água.
d) proporciona uma queda de pressão no interior da seringa que diminui o ponto de ebulição da água.
e) possibilita uma diminuição da densidade da água que facilita sua ebulição.
50-(ITA-SP)

Uma
bolha de gás metano com volume de 10 cm3 é
formado a 30 m de profundidade num lago. Suponha que o metano
comporta-se como um gás ideal de calor específico molar CV =
3R e considere a pressão atmosférica igual a 105 N/m2.
Supondo que a bolha não troque calor com a água ao seu redor,
determine seu volume quando ela atinge a superfície. Densidade da
água d=1.000kg/m3.
51-(UNESP-SP)

Os compostos orgânicos possuem interações fracas e tendem a apresentar temperaturas de ebulição e fusão menores do que as dos compostos inorgânicos. A tabela apresenta dados sobre as temperaturas de ebulição e fusão de alguns hidrocarbonetos.

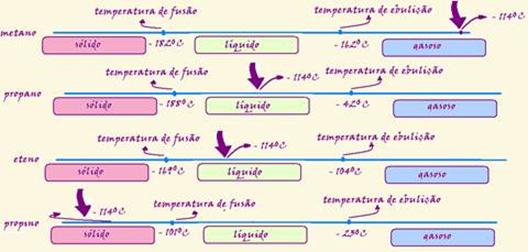
Na temperatura de –114 oC é correto afirmar que os estados físicos em que se encontram os compostos, metano, propano, eteno e
propino, são, respectivamente,
(A) sólido, gasoso, gasoso e líquido.
(B) líquido, sólido, líquido e sólido.
(C) líquido, gasoso, sólido e líquido.
(D) gasoso, líquido, sólido e gasoso.
(E) gasoso, líquido, líquido e sólido
Resolução comentada dos exercícios de vestibulares sobre
Mudanças de estado físico da matéria
01- R- A --- veja teoria
02- R- E --- veja teoria
03- R- B
04- Ele recebe calor que é utilizado apenas para fazer com que ele mude de estado e sua temperatura permaneça constante ---
R- C
05- Quanto maior a pressão, maior a temperatura de ebulição --- R- B
06- R- D --- veja teoria
07- R- B --- veja teoria
08- Para se refrescar uma bebida costuma-se colocar nela cubos de gelo a 0oC, em vez de mesma massa de água a 0oC para que o calor necessário para fundir o gelo seja aproveitado para resfriar a bebida --- R- A
09- Quanto menor a pressão, menor a temperatura de ebulição --- R- E
10- É diretamente proporcional à área da superfície de líquido exposta --- R- E
11- Depende da natureza do líquido que está evaporando. Assim, por exemplo, o éter evapora mais rapidamente que a água; é mais volátil que ela. As moléculas do éter, do álcool (ou da gasolina) se atraem umas às outras menos fortemente que as da água, e sua camada superficial é mais fraca. Por isso o éter, álcool (ou a gasolina) se evapora mais ràpidamente --- R- E
12- Se diminui o volume, aumenta a pressão sobre o vapor que se condensa mais --- R- B
13- Algumas substâncias, como a maior parte dos líquidos e dos metais, aumentam de volume ao se fundir e diminuem de volume ao se solidificar. Outras substâncias (como a água) se comportam de maneira oposta --- R- A
14- Ao nível do mar onde a pressão atmosférica é normal e vale 1 atm, em uma panela aberta a água ferve a 100oC. Se essa panela for fechada, o vapor de água que se forma no seu interior, não se dissipa para o ambiente aumentando a pressão interna da panela,
podendo
chegar até a 2atm, onde a água ferve a uma temperatura de
aproximadamente 120oC..
Nesta pressão a água ferve a uma temperatura aproximadamente igual
a 120°C. Assim, os alimentos cozinham em menor tempo. As panelas de
pressão possuem válvulas de segurança que funcionam quando a
pressão atingir um ponto perigoso --- R-
B
15- Se
determinada massa de água está se vaporizando, sob pressão normal,
o fenômeno está ocorrendo a 100oC
e, se você
aumentar o tamanho da chama, a temperatura da água continuará sendo de 100oC, apenas a vaporização será mais rápida --- R- E
16- À temperatura de -55oC a água em marte estaria no estado sólido --- R- E
17- Com a diminuição da pressão (está acima do nível do mar) a temperatura de fusão aumenta e a de vaporização diminui --- R- D
18- R- A --- veja teoria
19- À medida que a pressão aumenta a temperatura de vaporização da água também aumenta ---
R- B
20- R- A --- veja teoria
21- Durante toda a fusão a temperatura permanece constante --- R- C
22- Quanto maior a pressão, maior será a temperatura de ebulição e vice versa --- R- B
23- R- C --- veja teoria
24- 01. Falsa --- a temperatura está relacionada com o movimento vibratório (energia cinética) das moléculas.
02. Falsa --- durante a fusão e a ebulição a temperatura permanece constante.
04. Falsa --- ocorre com líquidos e sólidos
08. Correta --- calor é energia em trânsito de um corpo para outro em função da diferença de temperatura entre eles.
16. Correta --- o calor é uma onda eletromagnética (raios infravermelhos) que se propagam a partir do Sol, pelo vácuo
R- (8 + 16) = 24
25- A densidade do gelo é menor que a densidade da água ou seja, o gelo ocupa mais espaço do que a quantidade de água equivalente.
Assim, o volume de água proveniente do gelo derretido é igual ao volume de gelo que estava imerso. Portanto, o nível da água no balde não se altera --- R- E
Observação: Baseado nisso, observe que o derretimento de um ice-berg não altera o nível do mar. Existe muito gelo sobre as montanhas. E muito mais gelo sobre continente no Pólo Sul. É justamente este gelo que, ao derreter, escorre para o mar e contribui para o aumento do nível de água.
26- R- A --- veja teoria
27- I. Correta --- o éter ao se evaporar retira energia (calor) do local machucado.
II. Correta --- a evaporação independe da temperatura, mas ela é maior quanto maior for a temperatura.
III. Falsa --- quanto mais éter, maior a evaporação e maior será a redução de temperatura do local machucado.
R- D
28- Maior altura, menor pressão e menor temperatura de vaporização --- R- C
29- Uma
das razões que faz a água, próxima à superfície livre de alguns
lagos, congelar no inverno, em regiões de baixas temperaturas, é o
fato de que ao ser resfriada, no intervalo aproximado de 4 °C a 0
°C, ela sofre um processo de dilatação.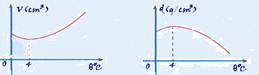
Com isso seu volume aumenta e sua densidade diminui. A água da superfície, mais fria e mais dessa, desce (correntes descendentes) e a água das profundezas, mais quente e menos densa sobe (correntes ascendentes).
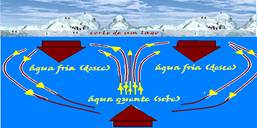
Essas correntes de convecção continuam seu movimento até toda água atingir a temperatura de 4oC (densidade máxima) quando cessam, porque toda água agora tem a mesma densidade.
Mas,
se a temperatura da superfície continua diminuindo até abaixo de
0oC,
a água da superfície se congela e esse gelo isola por condução o
ambiente acima da superfície da água (a menos de 0oC)
das águas abaixo da mesma que estão (a 4oC).
Devido a esse fenômeno é possível a vida nas profundezas de lagos e mares, mesmo estando coberta de gelo a sua superfície.
R- D
30- I. Correta --- II. Correta --- III. Correta --- IV. Falsa
R- (01 + 02 + 08)=11
31- Maior altitude, menor temperatura de ebulição --- R- D
32- R-E --- veja teoria
33- R- B --- veja teoria
34- O calor latente de vaporização da água é a quantidade de energia necessária para que uma quantidade de massa unitária (1 grama, 1 quilograma, 1 libra etc.) passe do estado líquido para o gasoso, não interessando em que temperatura o fenômeno ocorre --- R- C
35- a) Não ocorre ascensão de ar frio, pois este é mais denso. O que pode ocorrer é a ascensão de ar quente, por ser menos denso.
b) A sublimação envolve os estados gasoso e sólido. Está claro pelo texto que as gotas sofrem congelamento (solidificação).
c) As gotas não sofrem evaporação e sim solidificação.
d) O granizo é sólido e logo não sofre vaporização.
e)Para que o granizo precipite é necessário que a resultante ocorra em sentido à terra.
R- E
36- R- C --- veja teoria
37- R- D
38- R- D --- veja teoria
39- R- B --- veja teoria
40- Sublimação é a passagem sólido-vapor, que corresponde ao trecho HT (veja figura abaixo)
R- C
41- a)
Pela tabela, quando a pressão é de 880mmHg, a temperatura de
ebulição da água é de 105oC
--- no gráfico, quando T=105oC,
o tempo de cozimento é de 20
minutos.
b)
Se, para cada 100m de altitude a pressão diminui de 10 mmHg, na
altitude de 800m, ela sofrerá uma diminuição de 80 mmHg ---
então, em Gramado (800m de altitude) a pressão atmosférica será
--- P=760 – 80=680mmHg --- para essa pressão a
tabela nos fornece a temperatura de 97oC, que, no gráfico, nos
fornece o tempo correspondente --- t=60
minutos
c)
Ao nível do mar a pressão é de 760 mmHg e a temperatura de
ebulição da água é de 100°C --- no gráfico, para a
temperatura de 100°C temos um tempo de cozimento de 40 min
--- para o tempo de cozimento de 80 min, a temperatura de
fervura será de 95ºC, de acordo com o gráfico ---
verificando na tabela, a temperatura de 95°C corresponde á pressão
de 640 mmHg --- a diferença de pressão será ---
P=760 – 640=120mmHg --- a altitude correspondente será
de 1.200m.
42- R- A --- veja teoria
43- A água permanece em estado líquido, está em ebulição e o vapor é liberado para o ambiente pela válvula, a pressão e a temperatura aumentam (TA<TB e PA<PB) --- R- D
44- Havendo mudança na fase da água, sem a ocorrência da fase líquida, concluí-se que ocorre sublimação, o que valida a afirmação I.
A sublimação só pode ocorrer em pressão inferior à pressão do ponto triplo, o que valida a afirmação II.
A afirmação III estabelece uma relação direta entre fusão e ponto triplo o que a invalida.
R- D
45-
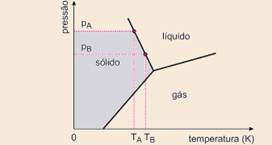
De imediato eliminamos as opções a) e b), pois a baixas temperaturas a água está na fase
gasosa --- a opção c) apresenta aumento de temperatura de fusão com o aumento de pressão --- abaixo mostramos a coerência da opção d) com o enunciado --- pA > pB --- TA < TB
R- D
46- a) A temperatura de ebulição de uma substância depende da própria substância e da pressão. Por isso que se usa a panela de pressão. Aumenta-se a pressão na superfície da água aumentando a dificuldade de as moléculas vaporizarem, aumentando, portanto, a temperatura de ebulição.
No caso dessa questão, ao se jogar água fria na tampa da jarra, diminui-se a pressão na superfície do líquido, diminuindo a temperatura de ebulição.
b) Aumentando a altitude, diminui-se a pressão, diminuindo a temperatura de ebulição da água. Somente para exemplificar: em São Paulo a água ferve a 98 °C, em Brasília, a 96 °C e, em La Paz, a 87 °C.
47- A temperatura de mudança de fase de uma substância pura e cristalina depende exclusivamente da pressão. No caso da água, a temperatura de vaporização é 100 °C. Atingida essa temperatura, todo calor absorvido é usado para mudança de fase. Se colocarmos a água numa panela de pressão ele irá ferver a uma temperatura constante maior que 100 °C, dependendo da pressão interna da panela --- R- C
48- As quantidades de calor sensível liberadas por cada uma das bolas são transferidas para os blocos de gelos.
Como o ferro tem maior condutividade térmica que a madeira, ele transfere calor mais rapidamente para o gelo, sofrendo um resfriamento mais rápido. --- a quantidade de calor sensível de cada esfera é igual, em módulo, a quantidade de calor latente absorvida por cada bloco de gelo --- Q=mcΔθ --- Como as massas das bolas são iguais e as variações de temperatura também, a massa de gelo fundida em cada caso é diretamente proporcional ao calor específico do material que constitui a bola. Assim, analisando a expressão, vemos que funde menor quantidade de gelo a bola de material de menor calor específico, no caso, a de metal.
R- C
49- Quando você puxa o êmbolo você está aumentando o volume da região onde está a água provocando uma diminuição da pressão e consequentemente a temperatura de ebulição diminui fazendo com que a água ferva a uma temperatura menor que 100oC --- R- D
50- Relação entre os calores específicos molares --- Cp – CV=R --- Cp – 3R=R --- Cp=4R --- CV=3R --- a razão entre esses calores específicos fornece o expoente λ --- λ=CV/CP=4R/3R=4/3 --- pressão p à 30m de profundidade --- P Po + dgh=105 + 103.10.30 --- P=105 + 3.105 --- P=4.105 N/m2 --- numa transformação adiabática de um gás ideal --- P.Vλ = Po.Voλ --- 4.105.104/3 = 105.Vo4/3 --- elevando os dois membros a ¾ --- (4.104/3)3/4 = (Vo4/3)3/4 --- 43/4.101 = Vo --- Vo=10 .4√43=10.4√(24.22) --- Vo=20.4√22 --- Vo≈28,3 cm
51- R- E --- veja esquema abaixo