 Calor
Latente – Trocas de calor com mudança de estado
Calor
Latente – Trocas de calor com mudança de estado Calor
Latente – Trocas de calor com mudança de estado
Calor
Latente – Trocas de calor com mudança de estado
Calor Latente
O calor recebido por um corpo pode fazer com que sua temperatura aumente ou que ele sofra uma mudança de estado. No segundo caso você tem uma quantidade de calor latente, ou seja, o calor

latente se refere à quantidade de calor que um corpo recebe apenas para mudar de estado, o que ocorre à temperatura constante.
Constata-se que a quantidade de calor latente (Q) cedida ou retirada de uma substância para que ela mude de estado o que sempre ocorre à temperatura constante é diretamente proporcional à sua massa (m), e depende das características da substância (L). Matematicamente:


Significado de Calor Latente
Se
você quiser saber, por exemplo, quantas
calorias são necessárias para
fundir
200g de alumínio,
você deve fazer
![]() Q
= m.L = 200.94
Q
= m.L = 200.94
![]() Q
= 18.800 cal ou Q = 18,8 kcal.
Q
= 18.800 cal ou Q = 18,8 kcal.
Curva de aquecimento - calor sensível e calor latente
Observe com muita atenção o gráfico abaixo e a sequência de figuras que ilustra o aquecimento, por exemplo, de certa massa de água sendo aquecida de gelo a -20oC até vapor de água a 120oC.


O que você deve saber, informações e dicas
![]()

Durante a fusão e a vaporização a temperatura permanece constante (0oC na fusão e 100oC na
vaporização) porque a energia térmica (calor) fornecida ao gelo foi utilizada apenas para convertê-lo em água líquida e a energia térmica (calor) fornecida à água líquida foi utilizada apenas para convertê-la em vapor, fazendo com que a temperatura nessas duas mudanças de estado físico permaneça constante (0oC na fusão e 100oC na vaporização).
![]()
Quando você afirma que o calor latente de fusão do gelo é de 80 cal/g, você quer dizer que, para a fusão de 1g de gelo ou para a solidificação de 1g de água, você deve ceder ou retirar 80 cal.
![]()
Curva de aquecimento – calor sensível e calor latente

![]()
Mudanças de estado físico

![]()
Resolvendo alguns exercícios sobre trocas de calor envolvendo calor sensível (específico) e calor latente:

Dados: calor específico do gelo = 0,5 cal/g°C; calor específico da água = 1 cal/g°C e calor latente de fusão do gelo = 80 cal/g
Resolução:
De
gelo
a -20oC
a gelo a 0oC
![]() não tem mudança de estado
não tem mudança de estado
![]() calor
sensível
calor
sensível
![]() Q1
= m.cgelo.
Q1
= m.cgelo.
∆θ
=
2.0,5.[0 – (-20)]
![]() Q1
=
20kcal (calor utilizado no aquecimento do gelo).
Q1
=
20kcal (calor utilizado no aquecimento do gelo).
De
gelo
a 0oC
a água a 0oC
![]() é
uma mudança de estado (fusão) à temperatura constante
é
uma mudança de estado (fusão) à temperatura constante
![]() calor
latente de fusão
calor
latente de fusão ![]() Q2
=
m.L =
2.80
Q2
=
m.L =
2.80
![]() Q2
=
160 kcal (calor utilizado apenas na mudança de estado).
Q2
=
160 kcal (calor utilizado apenas na mudança de estado).
De
água
a 0oC
a água a 50oC
![]() não tem mudança de estado
não tem mudança de estado
![]() calor
sensível
calor
sensível
![]() Q3
=
m.cágua.
∆θ =
2.1.(50 – 0)
Q3
=
m.cágua.
∆θ =
2.1.(50 – 0)
![]() Q3
=
100 kcal (calor utilizado no aquecimento da água até a
temperatura pedida, 50oC).
Q3
=
100 kcal (calor utilizado no aquecimento da água até a
temperatura pedida, 50oC).
A quantidade de calor total nesse aquecimento foi Qtotal = 20 + 160 + 100 = 280 kcal.
Como
a fonte
térmica fornece 20 kcal por minuto
![]() Δt =
Δt =
 =
14minx60 = 840 s.
=
14minx60 = 840 s.

Num
piquenique,
com a finalidade de se obter
água gelada, misturou-se
num garrafão
térmico,
de
capacidade térmica desprezível, 2kg de gelo picado a 0°C e 3kg de água que estavam em garrafas ao ar livre, à temperatura ambiente de 40oC.
Desprezando-se a troca de calor com o meio externo e conhecidos o calor latente de fusão do gelo (80 cal/g) e o calor específico da água (1 cal/g°C).
Calcule a massa de água gelada disponível para se beber, em kg, depois de estabelecido o equilíbrio térmico
Resolução:
Calor
necessário para
fundir
os 2 kg de gelo a 0 °C
![]() Q1
= m.L =
2000.80 =
160000 cal (calor utilizado para derreter os 2 kg de gelo).
Q1
= m.L =
2000.80 =
160000 cal (calor utilizado para derreter os 2 kg de gelo).
Calor
necessário para resfriar os 3 kg de água de 40oC
até 0 °C
![]() Q
= m.c.Δθ =
3000.1.(0-40) =
Q
= m.c.Δθ =
3000.1.(0-40) =
- 120000 cal (calor retirado dos 3 kg de para passar de 40oC até 0oC.
Observe
que o calor
liberado pela água, 120 kcal,
não
é suficiente para fundir todo gelo (visto
que são
necessários 160 kcal)
![]() portanto o equilíbrio
térmico ocorrerá a 0 °C,
sendo que os
3 kg de água líquida original continuará líquida e
teremos uma
parte do gelo derretida que vale
portanto o equilíbrio
térmico ocorrerá a 0 °C,
sendo que os
3 kg de água líquida original continuará líquida e
teremos uma
parte do gelo derretida que vale
![]() Q
= m.L
Q
= m.L
![]() 120000 = m.80
120000 = m.80
![]() m =
m =
 =
1500 g = 1,5 kg.
=
1500 g = 1,5 kg.
Assim a massa de água gelada final será de 3 kg (líquido já existente a 0oC) + 1,5 kg (gelo que derreteu) = 4,5 kg.
Exercícios de vestibulares com resolução comentada sobre
Calor Latente – Trocas de calor com mudança de estado
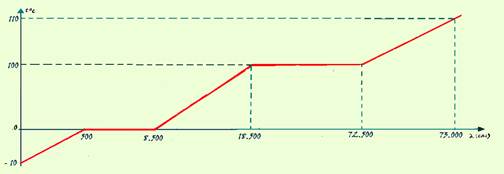
01-(UFB) Determine a quantidade de calor que se deve fornecer a 100g de gelo a -10oC para transformá-lo em vapor a 110oC. Esboce a curva de aquecimentodo processo.
Dados: calor específico da água = 1,0 cal/g °C --- calor específico do gelo = calor específico do vapor=0,5 cal/g °C --- calor latente de fusão do gelo = 80 cal/g --- calor latente de vaporização da água=540cal/g
02-(PUC-SP)
O
gráfico da quantidade de calor absorvida por um corpo de massa 5g,
inicialmente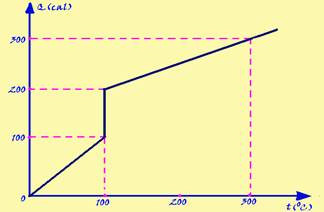
líquido, em função da temperatura T, em uma transformação sofrida por esse corpo, é dado pela figura.
a) Qual o calor latente de mudança de fase?
b) Qual o calor específico da substância no estado líquido?
03-(FUVEST-SP) O gráfico representa, em função do tempo, a leitura de um termômetro que mede a
temperatura
de uma substância inicialmente no estado sólido, contida num
recipiente. O conjunto é aquecido uniformemente numa chama de gás,
a partir do instante zero; depois de algum tempo o aquecimento é
desligado. A temperatura de fusão da substância é, em oC: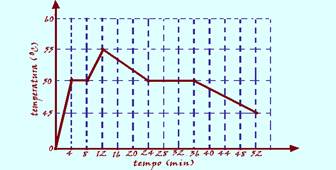
a) 40
b) 45
c) 50
d) 53
e) 55
04-(UFU-MG)
Na
aula de Física, o professor Chico Boca entrega aos estudantes um
gráfico da variação da temperatura (em °C) em função do calor
fornecido (em calorias). Esse gráfico, apresentado a seguir, é
referente a um experimento em que foram aquecidos 100 g de gelo,
inicialmente a -20°C, sob pressão atmosférica constante.
Em seguida, o professor solicita que os alunos respondam algumas questões. Auxilie o professor na elaboração do gabarito correto calculando, a partir das informações dadas,
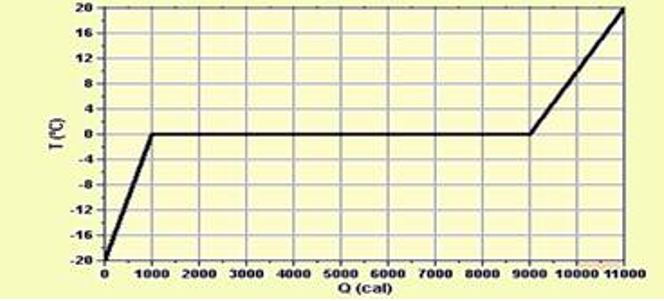
a) o calor específico do gelo;
b) o calor latente de fusão do gelo;
c) a capacidade térmica da quantidade de água resultante da fusão do gelo.
05-(ENEM-MEC)
A
Terra é cercada pelo vácuo espacial e, assim, ela só perde energia
ao irradiá-la para o espaço.
O aquecimento global que se verifica hoje decorre de pequeno desequilíbrio energético, de cerca de 0,3%, entre a energia que a Terra recebe do Sol e a energia irradiada a cada segundo, algo em torno de 1 W/m2. Isso significa que a Terra acumula, anualmente, cerca de 1,6 × 1022 J. Considere que a energia necessária para transformar 1 kg de gelo a 0°C em água líquida seja igual a 3,2 × 105 J. Se toda a energia acumulada anualmente fosse usada para derreter o gelo nos pólos (a 0°C), a quantidade de gelo derretida anualmente, em trilhões de toneladas, estaria entre
a) 20 e 40.
b) 40 e 60.
c) 60 e 80.
d) 80 e 100.
e) 100 e 120.
06-(PUC-PR) Uma fonte de energia (térmica), de potência constante e igual a 20 cal/s, fornece calor a uma massa sólida de 100 g.

O gráfico a seguir mostra a variação de temperatura em função do tempo:
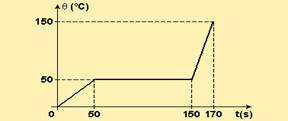
Marque a alternativa correta:
a) O calor latente de fusão da substância é de 200 cal/g.
b) A temperatura de fusão é de 150° C.
c) O calor específico no estado sólido é de 0,1 cal/g° C.
d) O calor latente de fusão é de 20 cal/g.
e) O calor específico no estado líquido é de 0,4 cal/g° C.
07-(UnB-DF)
Uma
dona de casa residente em Brasilia, precisando ferver água, resolveu
utilizar um ebulidor (vulgarmente conhecido como “mergulhão) ou
“rabo quente”, que é um equipamento elétrico capaz de fornecer
energia calorífica ao líquido noqual se encontra imerso.
Colocou, então, o ebulidor em um recipiente contendo 2,5
litros de água a 18oC,
ligando-o em seguida. Por um descuido, após atingir a temperatura de
ebulição de 96oC,
parte da água vaporizou. Ao desligar o ebulidor, a dona de casa
constatou que, naquele instante, restava apenas 1,5 litros de
água. Sabendo que o calor específico da água é 1,0 cal/goC,
e que a densidade da água é 1g/cm3,
bem como o clor latente de vaporização da água igual a 540
cal/g, e que 1 cal equivale a 4,2J e também que a potência do
ebulidor era de 1.000W. e considerando desprezível as trocas
de calor com o ambiente e o tempo de aquecimento do ebulidor,
calcule, em minutos, o tempo em que o ebulidor permaneceu ligado.
Despreze a parte fracionária de seu resultado, caso exista. 
08-(FUVEST-SP) Um recipiente de isopor, que é um bom isolante térmico, tem em seu interior água e gelo em equilíbrio térmico. Num dia quente, a passagem de calor por suas paredes pode ser estimada, medindo-se a massa de gelo Q presente no interior do isopor, ao longo de algumas horas, como representado no gráfico.
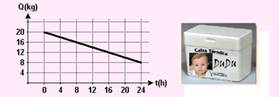
Esses dados permitem estimar a transferência de calor pelo isopor, como sendo, aproximadamente, de
Calor latente de fusão do gelo ¸ 320 kJ/kg
a) 0,5 kJ/h
b) 5 kJ/h
c) 120 kJ/h
d) 160 kJ/h
e) 320 kJ/h
09-(FUVEST-SP) As curvas A e B na figura representam a variação da temperatura (θ) em função do tempo(t) de duas substâncias A e B, quando 50g de cada uma é aquecida separadamente, a partir da temperatura de 20oC, na fase sólida, recebendo calor numa taxa constante de 20 cal/s.
Considere agora um experimento em que 50 g de cada uma das substâncias são colocados em contato térmico num recipiente termicamente isolado, com a substância A na temperatura inicial θA=280oC e a substância B na temperatura inicial θB=20oC.
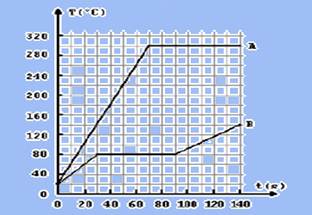
a) Determine o valor do calor latente de fusão LB da substância B.
b) Se a temperatura final corresponder à mudança de fase de uma das substâncias, determine a quantidade dela em cada uma das fases.
10-(UNESP-SP) A figura mostra os gráficos das temperaturas em função do tempo de aquecimento, em dois experimentos separados, de dois sólidos, A e B, de massas iguais, que se liquefazem durante o processo. A taxa com que o calor é transferido no aquecimento é constante e igual nos dois casos.
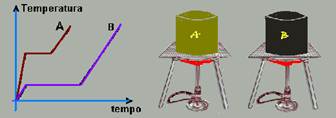
Se TA e TB forem as temperaturas de fusão e LA e LB os calores latentes de fusão de A e B, respectivamente, então
a) TA > TB e LA > LB.
b) TA > TB e LA = LB.
c) TA > TB e LA < LB.
d) TA < TB e LA > LB.
e) TA < TB e LA = LB.
11-(Olimpíada
Brasileira de Física)
Dentro
de um recipiente existem 2.400g de água e um pedaço de gelo. O
recipiente é colocado no fogão em uma chama branda que fornece
calor a uma razão constante. A temperatura foi monitorada durante 80
minutos e o resultado é o representado no gráfico.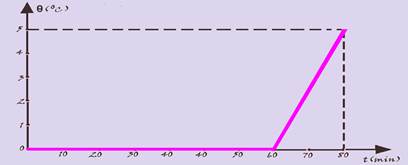
O calor latente de fusão do gelo é 80 cal/g e o calor específico da água líquida é 1 cal/goC. Calcule:
a) a massa inicial do gelo
b) a taxa de calor transferida ao sistema por minuto.
12-(PUC-RJ) Um calorímetro isolado termicamente possui, inicialmente, 1,0 kg de água a uma temperatura de 55 °C.

Adicionamos, então, 500 g de água a 25 °C. Dado que o calor especifico da água é 1,0 cal/(g.°C), que o calor latente de fusão é 80 cal/g e que sua densidade é 1,0 g/cm3, calcule:
a) a temperatura de equilíbrio da água;
b) a energia (em calorias - cal) que deve ser fornecida à água na situação do item a) para que esta atinja a temperatura de ebulição de 100 °C
c) quanto calor deve ser retirado do calorímetro, (no item b), para que toda a água fique congelada.
13-(FUVEST-SP)
Quando
água pura é cuidadosamente resfriada, nas condições normais de
pressão, pode permanecer no estado líquido até temperaturas
inferiores a 0°C, num estado instável de “superfusão”. Se o
sistema é perturbado, por exemplo, por vibração, parte da água se
transforma em gelo e o sistema se aquece até se estabilizar em 0°C.
O calor latente de fusão da água é L = 80 cal/g.
Considerando-se um recipiente termicamente isolado e de capacidade térmica desprezível, contendo um litro de água a –5,6°C, à pressão normal, determine:
a) A quantidade, em g, de gelo formado, quando o sistema é perturbado e atinge uma situação de equilíbrio a 0°C.
b) A temperatura final de equilíbrio do sistema e a quantidade de gelo existente (considerando-se o sistema inicial no estado de “superfusão” a –5,6ºC), ao colocar-se, no recipiente, um bloco metálico de capacidade térmica C=400cal/ºC, na temperatura de 91°C.
14-(FUVEST-SP)
Um
aquecedor elétrico é mergulhado em um recipiente com água a 10 °C
e, cinco minutos depois, a água começa a ferver a 100 °C. Se o
aquecedor não for desligado, toda a água irá evaporar e o
aquecedor será danificado. Considerando o momento em que a água
começa a ferver, a evaporação de toda a água ocorrerá em um
intervalo de aproximadamente
Calor específico da água = 1,0 cal/(g°C)
Calor de vaporização da água = 540 cal/g
Desconsidere perdas de calor para o recipiente, para o ambiente e para o próprio aquecedor.
a) 5 minutos.
b) 10 minutos.
c) 12 minutos.
d) 15 minutos.
e) 30 minutos.
15-(UFG-GO) Num piquenique, com a finalidade de se obter água gelada, misturou-se num garrafão térmico, de capacidade térmica desprezível, 2kg de gelo picado a 0°C e 3kg de água que estavam em garrafas ao ar livre, à temperatura ambiente de 40oC

Desprezando-se a troca de calor com o meio externo e conhecidos o calor latente de fusão do gelo (80 cal/g) e o calor específico da água (1 cal/g°C), a massa de água gelada disponível para se beber, em kg, depois de estabelecido o equilíbrio térmico, é igual a
![]()
16-(ITA-SP) Durante
a realização de um teste, colocou-se 1 litro de água a 20 °C no
interior de um forno de micro-ondas.
Após permanecer ligado por 20 minutos, restou meio litro de água. Considere a tensão da rede de 127 V e de 12 A a corrente consumida pelo forno. Calcule o fator de rendimento do forno.
Dados: calor de vaporização da água LV = 540 cal/g; calor específico da água c = 1 cal/g°C; 1 caloria = 4,2 joules.
17-(UNIFESP-SP)
A
enfermeira de um posto de saúde resolveu ferver 1,0 litro de água
para ter uma pequena reserva de água esterilizada. Atarefada, ela
esqueceu a água a ferver e quando a guardou verificou que restaram
950 mL.
Sabe-se que a densidade da água é 1,0 .103 kg/m3, o calor latente de vaporização da água é 2,3 . 106 J/kg e supõe-se desprezível amassa de água que evaporou ou possa ter saltado para fora do recipiente durante a fervura. Pode-se afirmar que a energia desperdiçada na transformação da água em vapor foi aproximadamente de:
a) 25 000 J.
b) 115 000 J.
c) 230 000 J.
d) 330 000 J.
e) 460 000 J.
18-(UFMG-MG) Em uma aula no Laboratório de Física, o Professor Jésus realiza o experimento que se descreve a seguir.
Inicialmente, ele imerge um aquecedor elétrico em 1,0 kg de água, à temperatura de 23 °C, contida num recipiente de isopor. Em seguida, o recipiente é tampado e o aquecedor é ligado, até a temperatura da água atingir 45 °C.
Considere
que a tensão e a corrente elétricas, no aquecedor, são,
respectivamente, de 220 V e de 1,0 A. Despreze a capacidade térmica
do recipiente e a do aquecedor.
a) Com base nessas informações, CALCULE o tempo que o aquecedor ficou ligado. Sabe-se que o calor específico da água é 4,2.103 J/kg.oC
b) Em seguida, o Professor Jésus coloca 0,60 kg de gelo, a 0,0 °C, na água contida no recipiente, tampa-o novamente, e espera até a temperatura dela se estabilizar. Sabe-se que o calor latente de fusão do gelo é de 3,3 × 105 J/kg. Considerando essas informações, CALCULE a temperatura da água no final desse experimento.
19-(FUVEST-SP) Um roqueiro iniciante (Marcus Lipas) improvisa efeitos especiais, utilizando gelo seco (CO2sólido) adquirido em uma fábrica de sorvetes. Embora o início do show seja à meia-noite (24 h), ele o compra às 18 h, mantendo-o em uma "geladeira" de isopor, que absorve calor a uma taxa de, aproximadamente, 60 W, provocando a sublimação de parte do gelo seco.
Para
produzir os efeitos desejados, 2 kg de gelo seco devem ser jogados em
um tonel com água, a temperatura ambiente, provocando a sublimação
do CO2 e
a produção de uma "névoa". A parte visível da "névoa",
na verdade, é constituída por gotículas de água, em suspensão,
que são carregadas pelo CO2 gasoso
para a atmosfera, à medida que ele passa pela água do tonel.
Estime:
a) A massa de gelo seco, Mgelo, em kg, que o roqueiro tem de comprar, para que, no início do show, ainda restem os 2 kg necessários em sua "geladeira".
b) A massa de água, Mágua, em kg, que se transforma em "névoa" com a sublimação de todo o CO2, supondo que o gás, ao deixar a água, esteja em CNTP, incorporando 0,01 g de água por cm3 de gás formado.
NOTE E ADOTE:
Sublimação: passagem do estado sólido para o gasoso.
Temperatura de sublimação do gelo seco = - 80 °C.
Calor latente de sublimação do gelo seco = 648 J/g.
Para um gás ideal, PV = nRT.
Volume de 1 mol de um gás em CNTP = 22,4 litros.
Massa de 1 mol de CO2 = 44 g.
Suponha que o gelo seco seja adquirido a - 80 °C.
20-(ENEM-MEC) A água apresenta propriedades físico-químicas que a coloca em posição de destaque como substância essencial à vida. Dentre essas, destacam-se as propriedades térmicas biologicamente muito importantes, por exemplo, o elevado valor de calor latente de vaporização. Esse calor latente refere-se à quantidade de calor que deve ser adicionada a um líquido em seu ponto de ebulição, por unidade de massa, para convertê-lo em vapor na mesma temperatura, que no caso da água é igual a 540 calorias por grama.
A propriedade físico-química mencionada no texto confere à água a capacidade de
a) servir como doador de elétrons no processo de fotossíntese.
b) funcionar como regulador térmico para os organismos vivos.
c) agir como solvente universal nos tecidos animais e vegetais.
d) transportar os íons de ferro e magnésio nos tecidos vegetais.
e) funcionar como mantenedora do metabolismo nos organismos vivos.
21-(UNESP-SP)
Ao
ser anunciada a descoberta de novo planeta em torno da estrela
Gliese581 e a possível presença de água na fase líquida em sua
superfície, reavivou-se a discussão sobre a possibilidade de vida
em outros sistemas.
Especula-se que as temperaturas na superfície do planeta são semelhantes às da Terra e a pressão atmosférica na sua superfície é estimada como sendo o dobro da pressão na superfície da Terra. A essa pressão, considere que o calor latente de vaporização da água no novo planeta seja 526 cal/g e a água atinja o ponto de ebulição a 120 °C. Calcule a quantidade necessária de calor para transformar 1 kg de água a 25 °C totalmente em vapor naquelas condições, considerando o calor específico da água 1 cal/goC.
22-(MACKENZIE-SP) Para certo procedimento industrial, necessita-se de água a 20 °C, mas só se dispõe de água no estado sólido a 0 °C (gelo) e água fervendo a 100 °C. A relação entre a massa de gelo e a massa de água fervendo que se deve misturar em um recipiente adiabático, para a obtenção do desejado, é
Dados: calor latente de fusão da água = 80 cal/g
calor específico da água líquida = 1 cal/(g°C)
![]()
23-(ITA-SP)
Um
corpo indeformável em repouso é atingido por um projétil metálico
com a velocidade de 300 m/s e a temperatura de 0°C. Sabe-se que,
devido ao impacto, 1/3 da energia cinética é absorvida pelo corpo e
o restante transforma-se em calor, fundindo parcialmente o projétil.
O metal tem ponto de fusão tf =
300°C, calor específico c = 0,02 cal/g°c e calor latente de fusão
Lf =
6 cal/g. Considerando 1 cal ¸ 4 J, a fração x da massa total do
projétil metálico que se funde é tal que
a) x < 0,25.
b) x = 0,25.
c) 0,25 < x < 0,5.
d) x = 0,5.
e) x > 0,5.
24-(ITA-SP) Um bloco de gelo com 725 g de massa é colocado num calorímetro contendo 2,50 kg de água a uma temperatura de 5,0°C, verificando-se um aumento de 64 g na massa desse bloco, uma vez alcançado o equilíbrio térmico. Considere o calor específico da água (c = 1,0 cal/g°C) o dobro do calor específico do gelo, e o calor latente de fusão do gelo de 80 cal/g. Desconsiderando a capacidade térmica do calorímetro e a troca de calor com o exterior, assinale a temperatura inicial do gelo.
![]()
25-(UFPB)
Em
um copo há 100g de água (calor específico c=1,0 cal/goC)
à temperatura de 30oC.
Desejando resfriar a água, coloca-se nesse copo 100g de gelo (calor
latente de fusão L=80cal/g) à temperatura de 0oC.
Considerando o copo um calorímetro de capacidade térmica
desprezível, após o equilíbrio térmico a temperatura será de
(em oC):
a) -20
b) -10
c) 0
d) 10
e) 20
26-(UFMA) Certa quantidade de gelo, a temperatura de -7°C foi colocado em um recipiente adiabático, de capacidade térmica desprezível, contendo 500g de água pura a temperatura de 40°C, sob pressao normal. Após algum tempo, a temperatura de equlibrio da mistura estabilizou-se em 30°C. Considerando que cgelo=0,5 cal/g.°C, cágua=1,0cal/g.°C e L=80 cal/g, a massa do gelo em gramas colocada no recipiente foi de, aproximadamente:
![]()
27-(UERJ-RJ)
Em
casa, é tarefa de a filha encher os recipientes de fazer gelo. Ela
pôs 100 g de água, inicialmente a 20 oC,
em um dos recipientes e o colocou no freezer, regulado para manter a
temperatura em seu interior a −19 0C,
sempre que a porta estiver fechada. No entanto, a porta ficou tanto
tempo aberta que a temperatura do ar dentro do freezer chegou a −
3 oC.
Sabendo que a pressão atmosférica local é 1 atm, e considerando que o ar no interior do freezer é um gás ideal, determine:
calor específico da água c=4.200J/kg.K --- calor latente de solidificação da água=3,3.105Jkg
a) a quantidade de calor que a água do recipiente deve perder para que se converta totalmente em gelo a 0 oC;
b) a pressão no interior do freezer imediatamente após a filha ter fechado a porta.
28-(UNESP-SP)
O
gálio é um metal cujo ponto de fusão é 30oC
à pressão normal; por isso ele pode liquefazer-se inteiramente
quando colocado na palma da mão de uma pessoa. Sabe-se que
ocalor específico e o calor latente de fusão do gálio são,
respectivamente, 410J/kgoC
e 80.000Jkg.
a) Qual a quantidade de calor que um fragmento de gálio de massa 25g, inicialmente a 10oC, absorver para fundir-se integralmente quando colocadona palma da mão de uma pessoa?
b) Construa o gráfico t (oC) x Q(J) que representa esse processo supondo que ele comece a 10oC e termine quando o fragmentode gálio se funde integralmente.
29-(UNICAMP-SP) Em
um dia quente, um atleta corre dissipando 750 W durante 30 minutos.
Suponha que ele só transfira esta energia para o meio externo,
através da evaporação do suor, e que todo seu suor seja
aproveitado para sua refrigeração.
Adote L = 2 500 J/g para o calor latente de evaporação da água na temperatura ambiente.
a) Qual é a taxa de perda de água no atleta em kg/min?
b) Quantos litros de água ele perde nos 30 min de corrida?
30-(UNIFESP-SP)
Em
dias muito quentes e secos, como os do último verão europeu, quando
as temperaturas atingiram a marca de 40 °C, nosso corpo utiliza-se
da transpiração para transferir para o meio ambiente sua energia
excedente. Por meio desse mecanismo, a temperatura de nosso corpo é
regulada e mantida em torno de 37 °C. No processo de transpiração,
a água das gotas de suor sofre uma mudança de fase à temperatura
constante, na qual passa lentamente da fase líquida para a gasosa,
consumindo energia, que é cedida pelo nosso corpo. Se, nesse
processo, uma pessoa perde energia a uma razão de 113 J/s, e se o
calor latente de vaporização da água é de 2,26.103 J/g,
determine a quantidade de água perdida na transpiração pelo corpo
dessa pessoa, em 1 hora.
31-(FGV-SP)
Um
suco de laranja foi preparado em uma jarra, adicionando-se, a 200mℓ
de suco de laranja a 20oC,
50g de gelo fundente. Dados: calor específico da água=1 cal/goC;
calor específico do suco de laranja=1 cal/goC;
densidade do suco de laranja=1.103g/ℓ;
calor latente de fusão do gelo=80cal/g. Estabelecido o equilíbrio
térmico, a temperatura do suco gelado era, e, oC,
aproximadamente:
a) 0,5
b) 1,2
c) 1,7
d) 2,4
e) 3,3
32-(UFG-GO)
Um
recipiente de material termicamente isolante contém 300 g de chumbo
derretido à sua temperatura de fusão de 327 °C. Quantos gramas de
água fervente devem ser despejados sobre o chumbo para que, ao final
do processo, toda a água tenha se vaporizado e o metal solidificado
se encontre a 100 °C? Suponha que a troca de calor se dê
exclusivamente entre a água e o chumbo.
Dados:
calor latente
de vaporização da água = 540 cal/g
calor latente de fusão do
chumbo = 5,5 cal/g
calor específico do chumbo = 0,03 cal/g °C
![]()
33-(MACKENZIE-SP)
No
interior de um calorímetro de capacidade térmica desprezível, que
contém óleo (c = 0,3 cal/g °C) a 30°C, colocamos uma pedra de
gelo (calor latente de fusão = 80 cal/g) de 40 g a 0 °C. A massa de
água (calor específico = 1 cal/g °C) a 70 °C que devemos
adicionar no calorímetro para restabelecer a temperatura inicial do
óleo é de:
a) 80g
b) 90g
c) 100g
d) 110g
e) 150g
34-(ITA-SP)
Um vaporizador contínuo possui um bico pelo qual entra água a
20 oC,
de tal maneira que o nível de água no vaporizador permanece
constante. O vaporizador utiliza 800 W de potência, consumida no
aquecimento da água até 100 oC
e na sua vaporização a 100 oC.
A vazão de água pelo bico é em mililitro por segundo:
Dados: calor específico da água = 1 cal/g °C; calor latente de vaporização da água = 540 cal/g; densidade da água = 1 g/ml; 1 cal = 4,2 J
a) 0,31
b) 0,35
c) 2,4
d) 3,1
e) 3,5
35-(UDESC-SC) O gráfico a seguir representa a variação da temperatura de 200,0 g de água, em função do tempo, ao ser aquecida por uma fonte que libera energia a uma potência constante.
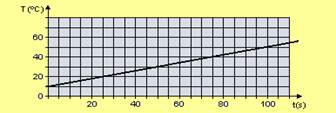
A temperatura da água no instante 135 s e o tempo que essa fonte levaria para derreter a mesma quantidade de gelo a 0°C são respectivamente:
![]()
36-(UNIFESP-SP) 0,50 kg de uma substância a temperatura To = 40°C, na fase líquida, é colocado no interior de um refrigerador, até que a sua temperatura atinja T1 = -10°C. A quantidade de calor transferida em função da temperatura é apresentada no gráfico da figura.
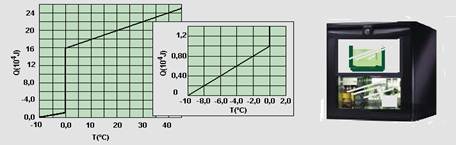
A parte do gráfico correspondente ao intervalo de -10°C a 2,0°C foi ampliada e inserida na figura, à direita do gráfico completo. Calcule:
a) O calor latente específico de solidificação.
b) O calor específico na fase sólida.
37-(UEG-GO) Considere que um bloco de gelo, inicialmente a 0 ºC, seja aquecido a uma taxa constante.
Um
tempo t é necessário para transformar o bloco de gelo completamente
em vapor d’água a 100 ºC. O que se tem após o tempo t/2?
Considere: calor latente de fusão do gelo = 80 cal/g; calor específico da água = 1 cal/g.°C e calor latente de vaporização da água = 540 cal/g.
a) Água a uma temperatura entre 0 ºC e 100 ºC.
b) Apenas gelo a 0 ºC.
c) Uma mistura de água e vapor a 100 ºC.
d) Uma mistura de gelo e água a 0 ºC.
38-(UNIFESP-SP) Em
uma experiência de Termologia, analisou-se a variação da
temperatura, medida em graus Celsius, de 100 g de uma substância, em
função da quantidade de calor fornecido, medida em calorias.
Durante o experimento, observou-se que, em uma determinada etapa do
processo, a substância analisada apresentou mudança de fase sólida
para líquida. Para visualizar o experimento, os dados obtidos foram
apresentados em um gráfico da temperatura da substância como função
da quantidade de calor fornecido. Determine: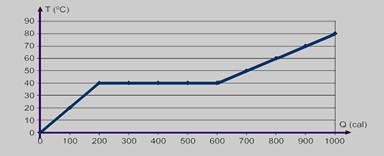
a) O calor específico da substância na fase líquida e seu calor latente específico de fusão.
b) Após a substância atingir a temperatura de 80 ºC, cessou-se o fornecimento de calor e adicionou-se à ela 50 g de gelo a 0 ºC. Supondo que a troca de calor ocorra apenas entre o gelo e a substância, determine a massa de água, fase líquida, em equilíbrio térmico.
Dados:
Calor latente de fusão do gelo: L = 80 cal/g --- Calor específico da água: c = 1,0 cal/(g.ºC)
39-(UNICAMP-SP)
Em
determinados meses do ano observa-se significativo aumento do número
de estrelas cadentes em certas regiões do céu, número que chega a
ser da ordem de uma centena de estrelas cadentes por hora. Esse
fenômeno é chamado de chuva de meteoros ou chuva de estrelas
cadentes, e as mais importantes são as chuvas de Perseidas e de
Leônidas. Isso ocorre quando a Terra cruza a órbita de algum cometa
que deixou uma nuvem de partículas no seu caminho. Na sua maioria,
essas partículas são pequenas como grãos de poeira, e, ao
penetrarem na atmosfera da Terra, são aquecidas pelo atrito com o ar
e produzem os rastros de luz observados.
a) Uma partícula entra na atmosfera terrestre e é completamente freada pela força de atrito com o ar após se deslocar por uma distância de 1 ,5 km . Se sua energia cinética inicial é igual a Ec = 4,5 × 104 J, qual é o módulo da força de atrito média? Despreze o trabalho do peso nesse deslocamento.
b) Considere que uma partícula de massa m = 0,1 g sofre um aumento de temperatura de Dq = 2400 ºC após entrar na atmosfera. Calcule a quantidade de calor necessária para produzir essa elevação de temperatura se o calor específico do material que compõe a partícula é c=0,90J/goC..
40-(PUC-SP) Um cubo de gelo de massa 100 g e temperatura inicial -10 ºC é colocado no interior de um micro-ondas.
Após
5 minutos de funcionamento, restava apenas vapor d' água.
Considerando que toda a energia foi totalmente absorvida pela massa
de gelo (desconsidere qualquer tipo de perda) e que o fornecimento de
energia foi constante, determine a potência utilizada, em W.
São dados: Pressão local = 1 atm --- Calor específico do gelo = 0,5 cal.g.oC-1 --- Calor específico da água líquida = 1,0 cal.g.oC-1 --- Calor latente de fusão da água = 80 cal. g-1 --- Calor de vaporização da água = 540 cal.g-1 --- 1 cal = 4,2 J
a) 1.008
b) 896
c) 1.015
d) 903
e) 1.512
41-(PUC-RJ)
Uma
quantidade de água líquida de massa m = 200 g, a uma temperatura de
30 oC,
é colocada em uma calorímetro junto a 150 g de gelo a 0 oC.
Após atingir o equilíbrio, dado que o calor específico da água é
ca =
1,0 cal/(g . oC)
e o calor latente de fusão do gelo é L = 80 cal/g, calcule a
temperatura final da mistura gelo + água.
a) 10oC
b) 15 oC
c) 0 oC
d) 30 oC
e) 60 oC
42-(PUC-RJ)
Um
cubo de gelo dentro de um copo com água resfria o seu conteúdo. Se
o cubo tem 10 g e o copo com água tem 200 ml e suas respectivas
temperaturas iniciais são 0 oC
e 24 oC,
quantos cubos de gelo devem ser colocados para baixar a temperatura
da água para 20 oC?
(Considere que o calor específico da água é ca = 1,0 cal/(g oC),
o calor latente de fusão do gelo L = 80 cal/g, e a densidade
da água, d = 1 g/ml)
a) 1
b) 2
c) 3
d) 4
e) 5
43-(UNIOESTE-PR) Se misturarmos, num recipiente de capacidade térmica desprezível, 150 g de água a 80ºC com 50 g de gelo a 0ºC, considerando o calor específico da água igual a 1 cal/gºC e o calor de fusão do gelo como 80 cal/g, a temperatura de equilíbrio da mistura será de
![]()
44-(UNICAMP-SP) Na
preparação caseira de um chá aconselha-se aquecer a água até um
ponto próximo da fervura, retirar o aquecimento e, em seguida,
colocar as folhas da planta e tampar o recipiente. As folhas devem
ficar em processo de infusão por alguns minutos. Caso o fogo seja
mantido por mais tempo que o necessário, a água entrará em
ebulição. Considere que a potência fornecida pelo fogão à água
é igual a 300 W, e que o calor latente de vaporização da água
vale 2,25 x 103 J/g.
Mantendo-se o fogo com a água em ebulição e o recipiente aberto,
qual é a massa de água que irá evaporar após 10 minutos?
a) 18 g.
b) 54 g.
c) 80 g.
d) 133 g.
45-(UECE-CE) Considerando que os calores específico e latente de vaporização da água são respectivamente c = 4.190 J/kg.K e L = 2.256 kJ/kg, a energia mínima necessária para vaporizar 0,5 kg de água que se encontra a 30ºC, em kJ, é aproximadamente:
![]()
46-(UFAC-AC)
Em
geral, a temperatura do ser humano é constante e igual a 37°C. A
hipotermia é caracterizada pela redução da temperatura padrão de
nosso corpo. A Medicina faz o uso controlado da hipotermia, em
determinadas cirurgias cerebrais e
cardíacas. Esse procedimento diminui o consumo de oxigênio do cérebro e do coração, bem como reduz a chance de danos ocasionados pela falta de circulação do sangue. Suponha que um paciente, de massa 60 kg, seja submetido a uma cirurgia de coração. A temperatura inicial de seu corpo é 37°C e pretende-se diminuí-la para 30°C. Considere o calor específico do corpo humano igual a 1,0 cal/g.°C e o calor latente de fusão do gelo igual a 80 cal/g. A massa mínima de gelo necessária para diminuir a temperatura do paciente até 30°C é:
![]()
47-(ENEM-MEC)

Em nosso cotidiano, utilizamos as palavras “calor” e “temperatura” de forma diferente de como elas são usadas no meio científico. Na linguagem corrente, calor é identificado como “algo quente” e temperatura mede a “quantidade de calor de um corpo”. Esses significados, no entanto, não conseguem explicar diversas situações que podem ser verificadas na prática.
Do ponto de vista científico, que situação prática mostra a limitação dos conceitos corriqueiros de calor e temperatura?
a) A temperatura da água pode ficar constante durante o tempo em que estiver fervendo.
b) Uma mãe coloca a mão na água da banheira do bebê para verificar a temperatura da água.
c) A chama de um fogão pode ser usada para aumentar a temperatura da água em uma panela.
d) A água quente que está em uma caneca é passada para outra caneca a fim de diminuir sua temperatura.
e) Um forno pode fornecer calor para uma vasilha de água que está em seu interior com menor temperatura do que a dele.
48-(UNICAMP-SP)

Na preparação caseira de um chá aconselha-se aquecer a água até um ponto próximo da fervura, retirar o aquecimento e, em seguida, colocar as folhas da planta e tampar o recipiente. As folhas devem ficar em processo de infusão por alguns minutos.
Caso
o fogo seja mantido por mais tempo que o necessário, a água entrará
em ebulição. Considere que a potência fornecida pelo fogão à
água é igual a 300 W, e que o calor latente de vaporização da
água vale 2,25.103 J/g.
Mantendo-se o fogo com a água em ebulição e o recipiente aberto,
qual é a massa de água que irá evaporar após 10 minutos?
a) 18 g.
b) 54 g.
c) 80 g.
d) 133 g.
49-(UEPG-PR)

No que se refere à mudança de estado da matéria, assinale o que for correto.
01) A quantidade de calor por grama necessária para que ocorra a mudança de estado é denominada de calor latente. Essa propriedade pode ser utilizada para diferenciar os materiais, adequando-os a seus diferentes usos.
02) A temperatura de mudança de estado é influenciada pela pressão a que a substância está submetida.
04) Tanto a vaporização como a condensação são processos que ocorrem por meio de troca de energia entre a substância e o meio no qual ela se encontra.
08) A evaporação ocorre a qualquer temperatura, mas a velocidade de evaporação do líquido aumenta com a elevação da temperatura.
50-(IFSP-SP)

Um
estudante de física, ao nível do mar, possui um aquecedor de
imersão de 420 W de potência e o coloca dentro de uma panela
contendo 2 litros de água a 20°C. Supondo que 80% da energia
dissipada seja absorvida pela água, o intervalo de tempo necessário
para que 20% dessa água seja vaporizada será aproximadamente de
Dados:
calor específico da água: 1,0 cal/g°C
Calor Latente de vaporização da água: 540 cal/g
Densidade absoluta da água: 1,0 kg/L
1 cal = 4,2 J
a) 1 h e 13 minutos.
b) 1 h e 18 minutos.
c) 1 h e 25 minutos.
d) 1 h e 30 minutos.
e) 2 h e 10 minutos.
51-(FUVEST-SP)

Um forno solar simples foi construído com uma caixa de isopor, forrada internamente com papel alumínio e fechada com uma tampa de vidro de 40 cm x 50 cm. Dentro desse forno, foi colocada uma pequena panela contendo 1 xícara de arroz e 300 mL de água à temperatura ambiente de 25°C.

Suponha que os raios solares incidam perpendicularmente à tampa de vidro e que toda a energia incidente na tampa do forno a atravesse e seja absorvida pela água. Para essas condições, calcule:
a) A potência solar total P absorvida pela água.
b) A energia E necessária para aquecer o conteúdo da panela até 100°C.
c) O tempo total T necessário para aquecer o conteúdo da panela até 100°C e evaporar 1/3 da água nessa temperatura (cozer o arroz).

52-(PUC-RJ)

Um copo com 300 ml de água é colocado ao sol. Após algumas horas, verifica-se que a temperatura

da água subiu de 10 °C para 40 °C. Considerando-se que a água não evapora, calcule em calorias a quantidade de calor absorvida pela água.
Dados: dágua=1g/cm3 e c=1cal/goC
(A) 1,5.105
(B) 2,0.105
(C) 3,0.103
(D) 9,0.103
(E) 1,2.102
53-(UFMG-MG)

01- Um copo com 200 g de água está inicialmente a 25oC. Carolina coloca 50 g de gelo, a 0oC, nesse copo.

Após algum tempo, todo o gelo derrete e toda água no copo está à mesma temperatura.
01. Considerando o sistema água e gelo isolado, calcule a temperatura no instante em que esse sistema chega ao equilíbrio térmico.
02- Assinalando com um X a quadrícula apropriada, responda:
Considerando-se, agora, o sistema isolado como água, gelo e copo, o valor obtido para a temperatura do sistema será menor, igual ou maior ao valor obtido no item 1, desta questão?
![]()
Justifique sua resposta.
54-(MACKENZIE-SP)

Um estudante, no laboratório de Física de sua escola, forneceu calor a um corpo de massa 50 g, utilizando uma fonte térmica de potência
constante. Com as medidas obtidas, construiu o gráfico ao lado, que representa a quantidade de calor ∆Q recebida pelo corpo em função de sua temperatura t.
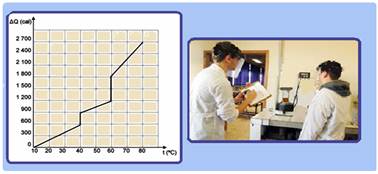
Analisando o gráfico, pode-se afirmar que o calor específico, no estado sólido e o calor latente de vaporização da substância que constitui o corpo, valem, respectivamente,
a) 0,6 cal/(g.ºC) e 12 cal/g
b) 0,4 cal/(g.ºC) e 12 cal/g
c) 0,4 cal/(g.ºC) e 6 cal/g
d) 0,3 cal/(g.ºC) e 12 cal/g
e) 0,3 cal/(g.ºC) e 6 cal/g
55-COLÉGIO NAVAL-011-012)

Durante uma expedição ao Polo Sul, um pesquisador precisou usar água líquida

na temperatura de 50°C para fazer um determinado experimento.
Para isso pegou 2kg de gelo que se encontravam à temperatura de -20oC e colocou uma fonte térmica fornecia 20 kcal/min.
Qual foi o tempo, em unidades do Sistema Internacional, que o pesquisador esperou para continuar o seu experimento?
Dados: calor específico do gelo = 0,5 cal/g°C; calor específico da água = 1 cal/g°C e calor latente de fusão do gelo = 80 cal/g
(A) 500
(B) 640
(C) 720
(D) 840
(E) 900
Resolução comentada dos exercícios de vestibulares sobre
Calor latente – trocas de calor com mudança de estado
01- Aquecimento do gelo --- Q1=m.c.(t – to)=100.0,5.(0 – (-10)) --- Q1=500cal
Fusão do gelo --- Q2=m.LF=100.80 --- Q2=8.000cal
Aquecimento da água --- Q3=m.c.(t – to)=100.1.(100 – 0) --- Q3=10.000cal
Vaporização da água --- Q4=m.LV=100.540 --- Q4=54.000cal
Aquecimento do vapor --- Q5=m.c.(t – to)=100.0,5.(110 – 100) --- Q5=500cal
QT=Q1 + Q2 + Q3 + Q4 + Q5=73.000cal ou Q5=73kcal
02- a) Q=m.L --- (200 – 100)=5.L --- L=20cal/g
b) Q=m.c.(t – to) --- (100 – 0)=5.c.(100 – 0) --- c=0,2cal/goC
03- R- C --- observe no gráfico
04- a) O primeiro trecho de gráfico corresponde ao aquecimento do gelo. Pela equação fundamental do calor sensível, Q = m.c.ΔT ---
1000 = 100.c.20 --- c = 0,5 cal/g.°C
b) O segundo trecho, uma linha horizontal sobre o eixo das abscissas, corresponde a fusão do gelo. Pela equação: Q = m.L ---
8000 = 100.L --- L = 80 cal/g
c) O terceiro e último trecho do diagrama corresponde ao aquecimento da água provinda da fusão do gelo. A capacidade térmica é dada pelo produto entre a massa e o calor específico sensível, ou seja, C = m.c --- C = 100.1 = 100 cal/°C
05- Etotal = 1,6 ×1022 J (Energia total acumulada pela Terra) --- Egelo = 3,2 ×105 J (Energia necessária para o derretimento de 1 kg gelo a 0°C) --- regra de três --- 1kg – 3,2.105J --- mkg – 1,6.1022J --- m=1,6.1022/3,2.105=0,5.1017J --- m=50.1015kg --- dividindo por 103 passa para tonelada --- m=50.1012ton --- m=50 trilhões de toneladas --- R- B
06- Durante a fusão ele recebe Q=20cal/s.100s=2.000cal --- Q=mL --- 2.000=100.L --- L=20cal/g --- R- D
07- Aquecendo 2,5.103g de água de 18oC a 96oC --- Q=mc(θ – θo)=2,5.103.1.(96 – 18) --- Q1= 1,95.105cal --- vaporização de 1,0.103g de água a96oC --- Q=mL=103.540 --- Q2=5,4.105cal --- calor total --- Qtotal=1,95.105 + 5,4.105 --- Qtotal=7,35.105cal --- Po=1.000W=1.000J/s --- Po=1.000/4,2cal/s --- Po=Q/Δt --- 1.000/4,2=7,35.105/Δt --- Δt=3.087s=51min
08- Pelo gráfico, em 24h 12kg de massa se fundem --- portanto em 1h, se funde m=0,5kg --- Q=m.L=0,5.320 --- Q=160kj ---
R- D
09- a) Substância B durante a fusão recebe de calor Q --- Q=Po.Δt=20.(90 – 30) --- Q= 1.200cal --- Q=m.L --- 1.200=50.L --- L=24 cal/g
b) calor específico da substância B --- Q=mcΔθ --- Q=Po.Δt --- Po Δt=mcΔθ --- cB=Po. Δt/mΔθ=20.30/50.(80 – 20) --- cA=0,2cal/goC --- energia térmica (calor) liberada pela substância B quando sua temperatura diminui de 280oC a 80oC --- QA=m.c.(80 – 280)=50.0,1.(-200) --- QA= - 1.000 cal --- energia térmica (calor) que a substância A deve receber para atingir a temperatura de 80oC --- QB=m.c.(80 – 20)=50.0,2.60 --- QB= 600cal --- a fusão da substância B é realizada com Q=1000 – 600=400cal --- Q=mL --- 400=m.24 --- mB=50/3g (parte de B que se liquefaz) --- no estado sólido B fica com ms=50 – 50/3 --- ms=100/3g --- observe que a temperatura de equilíbrio térmico entre A e B é de 80oC.
10- Observe que, pelo gráfico TA>TB --- como Q=m.L e como Q e m são as mesmas --- LA>LB --- R- C
11- a) fusão do gelo --- Q=mgeloLf --- potência da fonte --- Po=Q/Δt --- Q=Po.Δt --- Po.Δt=mgelo.Lf --- Po.60=mgelo.80 --- 3Po=4mgelo (I) --- aquecimento da massa (m=mágua + mgelo) de 0oC a 5oC --- Q’=mc(θ – θo)=(2.400 + mgelo).1.(5 – 0) --- Po.Δt’=(2.400 + mgelo).1.(5) --- Po.20=12.000 + mgelo --- 4Po=2.400 + mgelo (II) --- dividindo membro a membro (I) e (II) ---
3Po/4Po=4mgelo/2.400 + mgelo --- mgelo≈553,85 g
b) Substituindo mgelo=554,85 em I --- 3Po=4.553,85 --- Po≈738,47cal/min
12- a) Q1 + Q2=0 --- m1.c1.(T1-To1) + m2.c2.(T2-To2)=0 --- 1000 × 1,0 × (T - 55) + 500 × 1 × (T - 25 ) = 0 --- 1500 T = 67500 --- T = 45 °C.
b) m=1.000 + 500=1.500kg --- Q = 1500 × 1,0 × (100 - 45) = 1.500 × 55 = 82500 cal --- Q=82,5 kcal.
c) Para resfriar a água --- Q1 = - 1500 × 1 × 100 --- Q1= - 150 000 cal --- Para congelar a água --- Q2 = - 80 × 1500 cal ---
Q2=- 120 000 cal --- portanto o calor total a ser RETIRADO da água será --- Qt = Q1 + Q2 = - 270 000 cal --- Qt= - 270 kcal.
13- a) Calor que a água (m=1kg=1.000g) perde quando fica em superfusão, se solidificando de 0oC a -5,6oC --- Q=mcΔθ=1.000.1.(-5,6 – 0) --- Q=-5.600cal --- quando a superfusão cessa essa quantidade de calor torna sólida uma massa de água m com L=-80cal/g (perde calor ao se solidificar) --- Q=mL --- -5.600=m.(-80) --- m=70g
b) Quando o bloco metálico de massa m=930g à temperatura θo=91oC é colocado no recipiente onde você tem gelo a 0oC, água a 0oC, todo o sistema é aquecido até à temperatura t --- Fusão do gelo --- Q1=mL=70.80 --- Q1=5.600cal --- aqucimento da água --- Q2=mc(θ – θo)=1.000.1. (θ – 0) --- Q2=1.000.θ --- resfriamento do bloco metálico --- Q3= mc(θ – θo)=C.(θ – θo)=400.(θ – 91) --- Q3=400.θ – 36.400 --- Q1 + Q2 + Q3=0 --- 5.600 + 1.000.θ + 400.θ – 36.400=0 --- 1.400.θ=30.800 ---
θ=22oC
14- Potência da fonte térmica --- Po=energia/tempo=Q/Δt=m.c.(θ – θo)/Δt=m.1.(100 – 10)/5 --- Po=18m --- intervalo de tempo para a vaporização da água --- Q=Po.Δt=m.Lv --- 18m.Δt=m.540 --- Δt=15min --- R- D
15- Calor necessário para fundir os 2 kg de gelo a 0 °C --- Q = m.L = 2000.80 = 160000 cal --- calor necessário para resfriar os 3 kg de água até 0 °C --- Q = m.c.T = 3000.1.(0-40) = - 120000 cal --- observe que o calor liberado pela água, 120 kcal, não é suficiente para fundir todo gelo (visto que são necessários 160 kcal) --- portanto o equilíbrio térmico ocorrerá a 0 °C, sendo que os 3 kg de água líquida original continuará líquida e teremos uma parte do gelo derretida que vale --- Q = m.L --- 120000 = m.80 --- m = 120000/80 = 1500 g = 1,5 kg --- assim a quantidade de água gelada final será de 3 + 1,5 = 4,5 kg --- R- D
16- A quantidade efetiva de energia utilizada foi --- Q = m.c.∆T + m.L --- Q = 1000.1.(100-20) + 500.540 --- Q = 80000 + 270000 --- Q = 350000 cal = 1.470.000 J --- a quantidade de energia liberada foi --- W = P.∆t --- W = U.i.∆t --- W = 127.12.(20.60) --- W = 1.828.800 J --- o rendimento (η) será --- η =Q/W=1.470.000/1.828.800 --- η=0,80 --- η=80%
17- Volume que evaporou --- V=1000mL – 950mL=50mL=50.10-6 m3 --- V=0,050.10-3m3 --- d=m/V --- m=d.V --- Q=m.L=d.V.L --- Q=1,0.103.0,050.10-3.2,3.106 --- Q=115.000J --- R- B
18- a) P = U.i = 220.1 = 220 W = 220 J/s --- Q = m.c.Δθ=1.4,2.103.(45 – 23)=1.4,2.103.22 --- Q=9,24.104J --- Po=Q/∆t --- 220=9,24.104/∆t --- ∆t=420s=7min
b) Se a água está a 45 °C e sua temperatura cai para 0 °C, há liberação de --- Q = m.c. ∆θ = 1 . 4,2.103.45 = 189.000 J --- para fundir todo o gelo são necessários Q = m.L = 0,6.330.000 = 198.000 J --- como não ocorrerá o derretimento total do gelo, haverá gelo residual e, deste modo, a temperatura final desse experimento será 0 °C.
19- a)A sublimação do gelo seco ocorre devido ao calor absorvido pelo isopor --- ms – massa de gelo seco que sofreu sublimação entre 18h e 24h --- Δt=24 – 18=6h --- Po=Q/Δt --- Po=ms.L/Δt --- 60=ms.648.103/6x3.600 --- ms=2kg --- se ele vai utilizar 2kg e 2kg foram sublimados, a massa total adquirida foi de mt=4kg
b) Número de mols de gelo secoque sofre sublimação --- n=m/M=2.000/44 --- n=45,4545 --- n≈45,5 mol --- nas condições normais de pressão e temperatura (CNTP), 1 mol do gás ocupariam 22,4L, então 45,5 mol ocuparão um volume de V=45,5.22,4 --- V≈1.020L=1.020.103cm3 --- V≈1,02.106cm3 --- Como cada cm3 de gás formado carrega 0,01g, 1,02.106 cm3 carregará --- mt=0,101.1,02.106=1,02.104g --- mt=10,2kg
20- Devido ao alto calor específico da água, ela serve como regulador térmico para os seres vivos. Quando a temperatura do organismo aumenta, ele elimina água na forma de suor. Essa água, ao evaporar, absorve calor desse organismo, regulando sua temperatura. Cada 1 grama que se transforma em vapor absorve 540 cal --- R- B
21- De água a 25oC a água a 120oC --- Q1=m.c.Δθ=1.1.95 --- Q1=95kcal --- vaporizando a água a 25oC --- Q2=m.L=1.526 --- Q2=526kcal --- Qtotal=95 + 526 --- Qtotal=621kcal

R- Qtotal=621 kcal.
22-

23-

24- Q(gelo) + Q(agua) + Q(água congelada) = 0 --- 725.0,5.(0-x) + 2500.1.(0-5) + 64.(-80) = 0 --- -362,5.x - 12500 - 5120 = 0 ---
-362,5.x = 17620 --- x = -17620/362,5 = -48,6°C
R- B
25- Quantidade de calor máxima cedida pela água ao gelo --- Q=m.c.(t – to)=100.1.(0 – 30) --- Q= - 3.000cal --- essa quantidade de calor consegue fundir uma massa de --- Q=m.L --- 3.000=m.80 --- m=37,5g --- como existiam 100g de gelo e foram derretidos só 37,5g, sobraram no copo gelo e água a 0oC --- R- C
26- Qcedidoágua + Qrecebgelo + Qrecfusãogelo + Qgelo+água=0 --- mágua.cágua.(t – to) + mgelo.cgelo.(t – to) + mgelo.Lgelo + mgelo-água.cágua(t – to)=0 ---
500.1.(30 – 40) + mgelo.0,5.(0 – (-7)) + 80mgelo + mgelo.1.(30 – 0)=0 --- 113,5mgelo = 5.000 --- mgelo=44g --- R- B
27- a) Q= mágua.cágua.(t – to) + m.L=0,1x4.200x(0 – 20) + 0,1.3,3.105 --- Q=80.570cal ou Q=80,57kcal
b) porta fechada --- volume V constante --- Lei geral dos gases perfeitos --- Po.Vo/To=PV/T --- 1/293=P/270 --- P=0,92atm
28- a) Q=m.c.(t – to) + m.L=25.10-3.410.(30 – 10) + 25.10-3.80.000 --- Q=205 + 2.000 --- Q=2.205J
b)

29- a) Po=Q/Δt --- 750=Q/60 --- Q=45.000J --- 1g – 2.500J --- m – 45.000J --- m=45.000/2.500 --- m=18g=0,018kg --- a taxa é de 0,018kg/min
b) massa de água perdida pelo atleta --- m=0,018kg/minx30min --- m=0,54kg=0,54L
30- Q=m.L --- Po=Q/Δt --- Q=Po.Δt --- mL= Po.Δt --- m.2,26.103=113x3.600 --- m=180g
31- msuco.csuco.(t – to) + mgelo.Lf + mágua.cágua.(t – to)=0 --- 250.1.(t – 20) + 50.80 + 50.1.(t – 0)=0 --- 250t – 5.000 +4.000 + 50t=0 --- t=3,3oC
32- mchumbo.Lf + mchumbo.cchumbo.(t – to) + mágua.Lv=0 --- -300.5,5 + 300x0,03(100 – 327) + m.540=0 --- m=6,8g --- R- E
33- Observe que a temperatura inicial e final do óleo é a mesma, então ele pode ser excluido da resolução do exercício --- fusão do gelo a 0oC --- Q1=mL=40.80 --- Q1=3.200cal --- água de 00C a 30oC --- Q2=mcΔθ=40.1.30 --- Q2=1.200cal --- massa m de água a 70oC sendo resfriada até a temperatura θ --- Q3=mc(θ – θo)=m.1.(30 – 70) --- Q3=-40m --- Q1 + Q2 + Q3=0 --- 3.200 + 1.200 – 40m=0 --- m=110g
34- Em 1 s é fornecida a quantidade de calor --- Po=800W=800J/s =Q/Δt --- Q=800J=800/4,2cal --- esse Q aquece água de 20oC a 100oC (Q1) e depois a vaporiza a 100oC (Q2) --- Q1= mc(θ – θo)=m.1.80=80m --- Q2=mL=m.540 --- Q=Q1 + Q2 --- 800/4,2=540m + 80m --- m=0,31g --- d=m/V --- 1g/mℓ=0,31g/V --- V= 0,31mℓ --- vazão --- Va=0,31/1 --- Va=0,31 mℓ/s
35- De acordo com o gráfico no instante inicial a temperatura da água é de 10 °C e no instante 50 s é de 30 °C --- a quantidade de calor absorvida pela água foi de Q = m.c.DT = 200.1.(30-10) = 4000 cal --- o que significa que a fonte de calor possui fluxo de 4000 cal/50 s = 80 cal/s --- a partir do instante inicial considerando-se 135 s o total de calor fornecido para água, por esta fonte, será de 135.80 = 10.800 cal --- Q = m.c.DT --- 10.800 = 200.1.(T – 10) --- T = 64°C --- Para fundir 200 g de gelo são necessários --- Q = m.L = 200.80 = 16000 cal --- com um fluxo de 80 cal/s --- 16000/80 = 200 s --- R- A
36- a)Observe nos gráficos que a mudança de estado físico, solidificação, ocorreu entre as leituras de calor 16.104 J (veja no gráfico maior) e 1.104 J (veja no detalhe gráfico a direita) --- Q = m.L --- (1.104 – 16.104) = 0,5.L --- -15.104 = 0,5.L --- L = -30.104 =L=-3,0.105 J/kg
b) o resfriamento na fase sólida pode ser lido no detalhe gráfico, onde se pode ver que este resfriamento ocorreu entre 1.104 J e zero. --- Q = m.c.DT --- (0 – 1.104) = 0,5.c.(-10 – 0) --- -104 = -5.c --- c = 2000 J/(kg°C) = 2 kJ/(kg°C)
37- Calor de fusão do gelo --- Qg = mLg = m(80) --- calor sensível da água: Qa = mcaDT = m(1)(100) = m(100) --- calor de vaporização da água: Qv = mLv = m(540) --- a quantidade de calor até o instante t é --- Q = Qg + Qa + Qv = m(80) + m(100) + m(540) = m(720) --- como o calor é fornecido à taxa constante, até o instante t/2 a quantidade fornecida é Q/2= m(360) --- essa quantidade de calor é suficiente para derreter o gelo e aquecer a água até 100°C e vaporizar uma massa m’ de água, que pode ser calculada por --- m(360) =m(80) + m(100) + m’(540) --- m’(540) = m(360) – m(180) --- m’(540) = 180 m Þ m’ =m/3 --- assim, na metade do tempo teremos uma mistura de água e vapor a 100 °C, restando 2/3 da massa inicial da água --- R- C
38- a) Dado: m = 100 g. --- pela leitura do gráfico, conclui-se que --- de 0°C até 40 °C a substância esteve na fase sólida --- a fusão ocorreu na temperatura de 40 °C com absorção de 400 cal --- após a fusão, iniciou-se novo aquecimento, de 40 °C a 80 °C --- na fase líquida a quantidade de calor absorvida foi --- Qs = 1.000 – 600 = 400 cal --- Qs = m c DT --- c=Q/mΔT ---
Q=400/100x40 --- c = 0,1 cal/g.°C --- durante a fusão, a temperatura se manteve constante, absorvendo nesse processo --- Q = 600 – 200 = 400 cal --- QL=mL --- L=400/100 --- L=4 cal/g
b) Dados: mg = 50 g; Lg = 80 cal/g; cag = 1 cal/g.°C --- quantidade calor necessária para fundir totalmente o gelo --- Qg = m Lg --- Qg = 50 (80) = 4.000 cal --- se a substância recebeu 1.000 cal para aquecer de 0 °C até 80 °C, para retornar a 0°C, fazendo o processo inverso, ela liberou, também, 1.000 cal, que foram absorvidas pelo gelo --- essa quantidade é insuficiente para fundir totalmente o gelo --- a massa (m’) de gelo fundida é, então, a que recebeu Q’= 1.000 cal --- Q’= m’ Lg Þ 1.000 = m’ (80) ---
m’ = 12,5 g.
39-

40- m = 100 g; cgelo = 0,5 cal/g.°C; Lfusão = 80 cal/g; cágua = 1 cal/g.°C; LV = 540 cal/g; Dt = 5 min = 300 s e 1 cal = 4,2 J --- a quantidade de calor total é igual ao calor sensível do gelo de –10°C até 0 °C, mais o calor latente de fusão do gelo, mais o calor sensível da água de 0 °C a 100 °C e mais o calor de vaporização da água --- Q = Qgelo + Qfusão + Qágua + Qvaporização --- Q = m cgelo DTgelo + m Lfusão + m cágua DTágua + m LV --- Q = 100 (0,5) [0 – (-10)] + 100 (80) + 100 (1) (100 – 0) + 100 (540) ---
Q = 500 + 8.000 + 10.000 + 54.000 --- Q= 72.500 cal=72.500x4,2 --- Q=304.500J --- Po=Q/Δt=304.500/300 --- Po=1.015W --- R- C
41- mágua = 200 g; mgelo = 150 g; to = 30 °C; cágua = 1 cal/g.°C; Lgelo = 80 cal/g --- nesse tipo de problema, envolvendo gelo e água, você precisa sempre verificar se, no equilíbrio térmico, sobra gelo ou se há fusão total --- para isso, tem que comparar o calor latente necessário para fusão do gelo (Qgelo) com o calor sensível liberado pela água (Qágua) até 0 °C ---
Qgelo = mgelo Lgelo = 150 (80) --- Qgelo = 12.000 cal --- Qágua = mágua cágua DT = 200 (1) (0 – 30) --- Qágua = – 6.000 cal ( o sinal negativo indica apenas que houve liberação de calor) --- Comparando essas quantidades de calor (em módulo), verificamos que a quantidade de calor necessária para fundir o gelo (12.000 cal) é menor que a quantidade de calor liberada pela água (6.000 cal --- apenas metade da necessária). Portanto, apenas metade da massa de gelo se funde e a temperatura de equilíbrio térmico é 0 °C.
R- C
42- Quantidade calor liberada pela água para o resfriamento desejado --- Qágua = m água cágua |DT| = 200 (1) |20 – 24| --- Q=-800cal
--- quantidade de calor necessária para fundir um cubo de gelo --- Qcubo = mcubo Lfusão = 10 (80) = 800 cal --- Qágua + Qcubo=0
--- sendo a quantidaded de calor cedida igual à recebida, você deve observar que basta um cubo de gelo para provocar o resfriamento desejado da água --- R- A
43- Fusão do gelo Q1=mL=50.80 --- Q1=4.000cal --- resfriando água de 80oC a 0oC --- Q2=mcΔt=150.1.80 --- Q2=- 12.000cal ---
o calor fornecido pela água derreteu o gelo e ainda sobraram 8.000cal para aquecer as (150 + 50)g restantes até uma temperatura t --- Q=mcΔt --- 8.000=200.1.(t – 0) --- t=8.000/200 --- t=40oC --- R- E
44- A quantidade de calor liberada pelo fogão é --- Q = P Dt = m L Þ m = P.Δt/L=300x600/2,25.103 --- m=80g --- R- C
45- água a 30oC a água a 100oC --- Q1=mcΔθ=0,5x4.190.(100 – 30) --- Q1= 146.650J=146.65kJ --- vaporizando água a 100oC --- Q2=m.L=0,5.2.246 --- Q2=1.123kJ --- Q=Q1 + Q2=146,65 + 1.123=1.269,65kJ --- R- B
46- Quantidade de calor que deve ser retirada do corpo para que sua temperatura diminua de 37oC para 30oC --- Q=mcΔθ=60.1.(30 – 37) --- Q= - 420kcal --- essa quantidade de calor em módulo deve ser fornecido pelo gelo a 0oC e fusão --- Q=mL --- 420=m.80 --- m=5,25kg --- R- E
47- No sentido científico, supondo que a água esteja fervendo a céu aberto, ao nível do mar, haverá, por conta do recebimento de
energia (calor), ebulição --- a temperatura da massa líquida permanecerá constante e sempre de 100oC, logo, a energia cinética

média por molécula permanecerá constante --- porém, haverá cada vez menos moléculas na massa líquida --- portanto, a quantidade de energia da massa líquida diminui, apesar do recebimento de energia --- assim, se você entendesse a quantidade de calor do corpo como temperatura, como na linguagem corrente, sería obrigado a dizer que a temperatura da água diminui durante o tempo em que estiver fervendo --- R- A
48- Dados --- L = 2,2.103 J/g --- P = 300 W --- ∆t = 10 min = 600 s --- quantidade de calor liberada pelo fogão --- P=Q/∆t ---Q=P.∆t --- Q=m.L ---P. ∆t=m.L --- m=P.∆t/L=300.600/2,25.103 --- m=80g --- R- C
49- 01. Correta --- veja teoria
02) Correta --- veja como exemplo a fusão da água --- na patinação sobre o gelo, o deslizamento é facilitado porque, quando o

patinador passa, parte do gelo se transforma em água, reduzindo o atrito --- estando o gelo a uma temperatura inferior a 0ºC, isso ocorre porque a pressão da lâmina do patim sobre o gelo faz com que ele derreta --- isso ocorre porque um aumento da pressão diminui a temperatura de fusão --- outro exemplo, vaporização da água --- uma panela de pressão cozinha alimentos em água em um tempo menor do que as panelas comuns --- esse desempenho da panela de

pressão se deve ao fato de que a tampa provoca no interior da panela um aumento da pressão que, por sua vez provoca também um aumento na temperatura de vaporização fazendo a água ferver a uma temperatura acima de 100oC.
04. Correta --- veja teoria
08. Correta --- com o aumento de temperatura, a energia cinética média das moléculas aumenta, e assim, mais moléculas conseguem se transformar em vapor, aumentando a velocidade de evaporação.
R- (01 + 02 + 04 + 08) = 15
50- Dados --- V = 2 L --- P = 420 W --- c = 1 cal/g.°C = 4,2 J/g.°C --- L = 540 cal/g = 2.268 J/g --- d = 1 kg/L --- ∆T = (100 – 20) = 80 °C --- massa de água usada --- d=m/V --- 1=m/2 --- m=2kg=2.000g --- quantidade de calor necessária para que 20% da massa (0,2 M) de água seja vaporizada --- Q = Qsensível + Qlatente --- Q = M c ∆T + (0,2 M) L --- Q = 2.000 (4,2) (80) + (0,2x2.000)x2.268 = 67.200 + 907.200 --- Q = 1.579.200 J --- a potência útil é 20% da potência total --- Pútil = 0,8 P = 0,8 (420) --- Pútil = 336 W --- Pútil=Q/∆t --- ∆t=Q/Pútil=1.579.200/336 --- ∆t=4.700s --- ∆t=1h, 18min e 20s --- R- B
51- a) Cálculo da área da tampa (40 cm:50 cm) --- A = 0,4 m.0,5 m --- A=0,2m2 --- potência solar incidente na Terra (placa e

consequentemente na água) (1 kW por m2) --- 1m2 – 1 kW --- 0,2m2 – Po --- Po=0,2.1 --- Po=0,2 kW
b) A quantidade de energia (E) necessária para aquecer a água no interior da panela é dada por --- Q=E=mc∆t --- E=300.4.(100 – 25) --- E=90.000J ou E=90 kJ
c) A quantidade de energia (E‘) para aquecer a água de 25oC até 100°C é de 90.000 J (item anterior) --- para evaporar 1/3 da água --- m=300/3=100g --- Q’=E’=mL=100.2.200 --- E’ = 220.000 J --- Etotal = =90.000 + 220.000 --- Etotal=310.000 J ---
Po=Etotal/∆t --- 200=310.000/∆t --- ∆t=1.550 s
52-
V=300ml=300.10-3l=0,3l=0,3.103cm3 --- d=mV --- 1=m/0,3.103 --- m=0,3.103g=300g --- como a água não evapora, trata-se apenas de calor sensível, sem mudança de estado --- Q=m.c.(θ – θo)=300.1.(40 – 10) --- Q=9.000 cal --- R- D
53- Como o enunciado pede para considerar o sistema água e gelo isolado haverá trocas de calor somente entre eles e, ao final dessas trocas você terá apenas água líquida à temperatura de equilíbrio térmico θe --- Q – quantidade de calor cedido pelos 200g de água a 25oC para sua temperatura passar de 25oC a θe --- Q=m.c.(θe – θ)=200.1.(θe – 25) --- Q=200.θe – 5000 --- Q’ – calor recebido pelos 50g de gelo a 0opara mudar de estado e se transformar em 50g de água a 0oC --- Q’=m.L=50.80 --- Q’=4000cal
Q’’ - calor absorvido pelos 50g de água a 0oC a 50g de água a θe --- Q’’=m.c.(θe – 0)=50.1.θe --- Q’’=50.θe --- a soma algébrica dessas quantidades de calor trocadas pelo sistema é nula --- Q + Q’ + Q’’ = 0 --- 200.θe – 5000 + 4000 + 50.θe=0 ---
250.θe = 1000 --- θe=4oC
02- Maior --- você pode, agora incluindo o copo nas trocas de calor, efetuar o equilíbrio térmico entre toda a água (250g) a 4oC com o copo que está a 25oC e, é claro que a temperatura final estará entre 4oC e 25oC, ou seja, será maior que 4oC.
54- Como a fusão e a vaporização ocorrem à temperatura constante, pelo gráfico a fusão ocorre à temperatura de 40oC e a

vaporização à temperatura de 60oC --- portanto entre 10oC e 40oC o corpo se encontra no estado sólido, entre 40oC e 60oC, no estado líquido e, a partir de 60oC no estado gasoso --- calor específico no estado sólido --- Q=m.c.(θ – θo) --- (600 – 0)=50.c.(40 – 10) --- c=0,4cal/goC ---
A vaporização ocorre na temperatura de 60oC e para isso o corpo recebeu Q=1.800 – 1.200=600cal --- Q=m.L --- 600=50L --- L=12cal/g --- R- B
55- De gelo a -20oC a gelo a 0oC --- calor sensível --- Q1=m.cgelo.∆θ=2.0,5.[0 – (-20)] --- Q1=20kcal --- de gelo a 0oC a água a 0oC --- calor latente de fusão --- Q2=m.L=2.80 --- Q2=160kcal --- de água a 0oC a água a 50oC --- calor sensível --- Q3= m.cágua.∆θ=2.1.(50 – 0) --- Q3=100kcal --- Qtotal=20 + 160 + 100=280kcal --- como a fonte térmica fornece 20kcal por minuto --- t=280kcal/20kcal/min=14minx60=840s --- R- D.
|
|
|
|