Termodinâmica – 2020
Vestibulares recentes – Física Térmica
Termodinâmica
Transformações gasosas
01- (IFG – Instituto Federal de Educação, Ciência e Tecnologia de Goiás – 2020)

A charge aborda as mudanças de estados físicos pelas quais a água passa.

Essas mudanças são muito importantes para o ciclo da água. A respeito desses processos, podemos afirmar que:
a) No terceiro quadrinho observa-se o fenômeno de sublimação, no qual a água passa da fase líquida para a fase gasosa, formando as nuvens.
b) Durante o processo de solidificação, as moléculas de água se afastam umas das outras, fazendo com que o gelo tenha maior densidade que a água no estado líquido.
c) O derretimento de geleiras, causado pelo aquecimento global, tem afetado o equilíbrio do planeta, comprometendo a sobrevivência dos ursos polares.
d) Durante o processo de condensação, a água passa do estado sólido para o líquido. Nesse estado, a água assume a forma do objeto que a contém.
a) Falsa – A sublimação é a mudança do estado sólido para o estado gasoso, sem passar pelo estado líquido.
b) Falsa – o gelo tenha menor densidade que a água no estado líquido, por isso, flutua.
c) Correta
d) Falsa – Condensação é uma das fases em que ocorre a transformação da matéria, do estado gasoso para o estado líquido.
R- C
02- (Universidade Federal de Lavras – UFLA – MG – 2020)

Uma panela de pressão é um utensílio doméstico utilizado para o cozimento dos alimentos em altas temperaturas.
Ela é composta por uma tampa que veda parcialmente o seu interior, impedindo o escapamento de vapor.
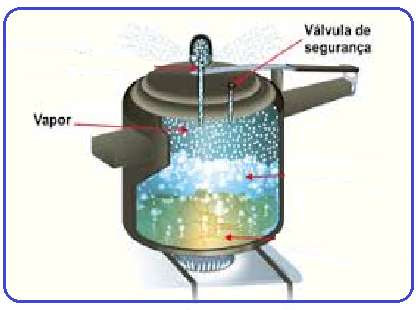
Ao fornecer calor à água em seu interior, o ar aprisionado aquece-se, provocando um aumento da pressão interna da panela, o que consequentemente eleva a temperatura de ebulição da água.
O resultado disso é que a água ferve a uma temperatura acima de 100°C, tornando o cozimento de alimentos mais rápido.
Considerando o vapor de água dentro da panela como se fosse um gás ideal, o gráfico que relaciona duas das grandezas físicas envolvidas no processo até a ebulição da água é o apresentado na alternativa:
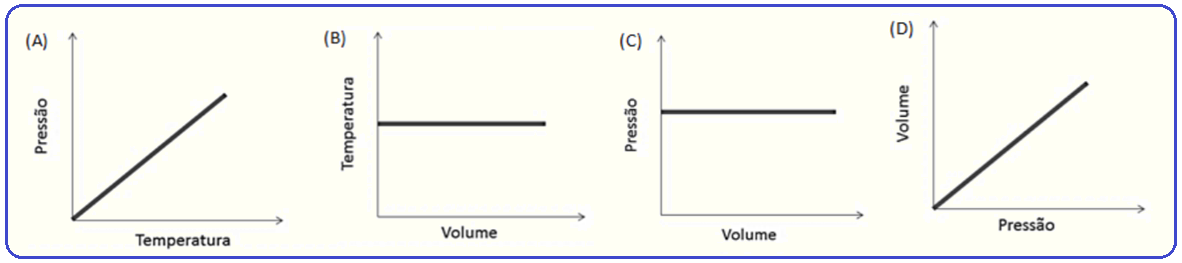
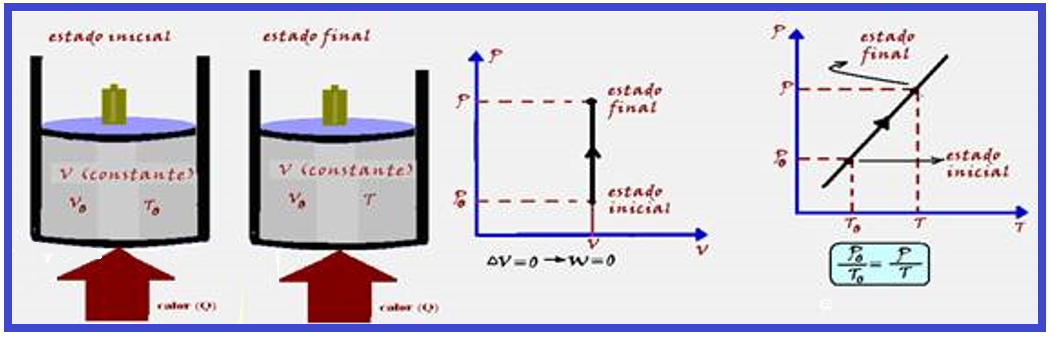
Transformação isocórica, isométrica ou isovolumétrica
Nessa transformação o volume é mantido constante.
Os físicos Jacques Charles e Gay-Lussac descobriram experimentalmente que, numa transformação isocórica, a pressão (P) é diretamente proporcional à temperatura absoluta (T), ou seja:
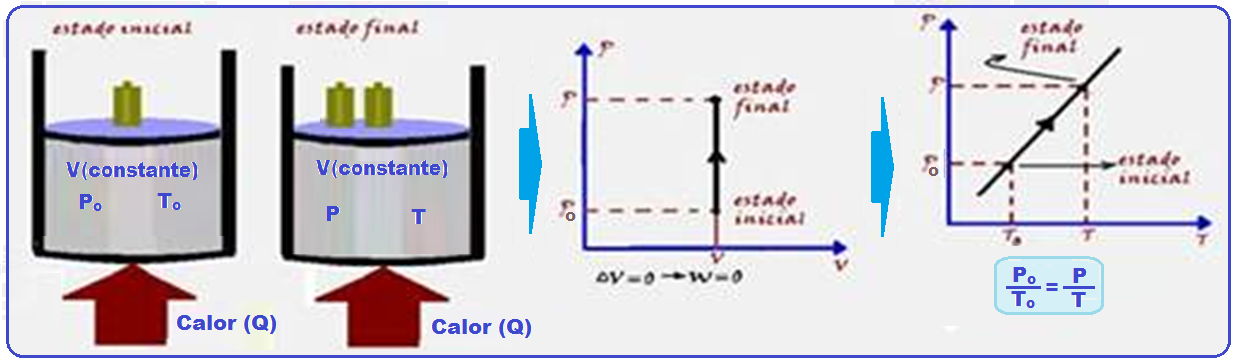
Veja o gráfico PxT à direita acima.
R- A
03- (Faculdade de Medicina do ABC – FMABC – SP – 2020)

O pneu de um automóvel foi calibrado à temperatura ambiente, mas, depois de trafegar durante certo tempo, a temperatura do ar no interior do pneu aumentou.
Considerando que o ar se comporte como um gás ideal, que não houve vazamento de ar do pneu e que o volume do pneu não variou, pode-se afirmar, sobre o ar no interior do pneu, que
(A) sua pressão aumentou e sua densidade diminuiu.
(B) sua pressão aumentou e sua densidade não variou.
(C) sua pressão diminuiu e sua densidade não variou.
(D) sua pressão aumentou e sua densidade também aumentou.
(E) sua pressão diminuiu e sua densidade também diminuiu.
Transformação isocórica, isométrica ou isovolumétrica
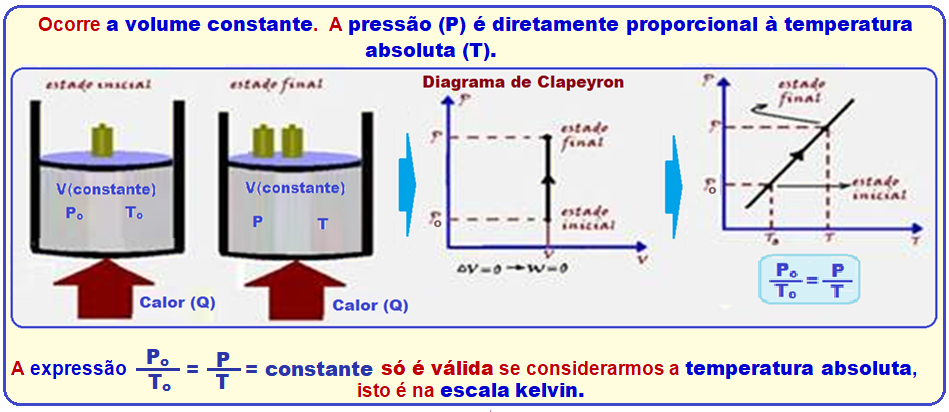
Como nessa transformação a pressão é diretamente proporcional à temperatura, se a temperatura aumenta, a pressão interna do pneu também aumentará.
Sendo a densidade do ar no interior do pneu densidade = 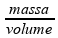 e sendo a massa de ar a mesma, e o volume o mesmo, a densidade do ar também será a mesma.
e sendo a massa de ar a mesma, e o volume o mesmo, a densidade do ar também será a mesma.
R- B
04- (ESCOLA TÉCNICA ESTADUAL – ETEC – SP – 2020)

Durante uma reação química realizada em meio aquoso, observa-se a variação da temperatura do sistema de 22 ºC para 28 ºC
Conclui-se, corretamente, que se trata de uma reação
(A) exotérmica, pois cedeu calor para o sistema.
(B) exotérmica, pois absorveu calor do sistema.
(C) endotérmica, pois cedeu calor para o sistema.
(D) endotérmica, pois absorveu calor do sistema.
(E) isotérmica, pois não houve troca de energia.
Todas as reações químicas e bioquímicas liberam ou absorvem energia do ambiente de alguma forma.
Os processos que liberam calor são denominados exotérmicos e nos transmitem sensação de aquecimento. A temperatura final dos produtos é maior que a temperatura inicial dos reagentes.
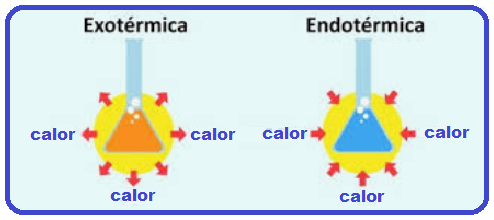
Os processos que absorvem calor são denominados endotérmicos e nos transmitem sensação de resfriamento.
A temperatura dos produtos finais é menor que a dos reagentes.
R- A
05- (FPS-Faculdade Pernambucana de Saúde-PE-2020)

Um mol de um gás monoatômico ideal sofre a transformação mostrada no diagrama P-V abaixo.
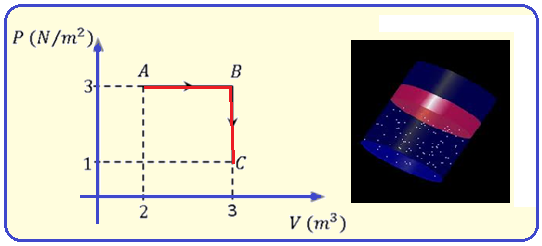
Determine a relação entre as temperaturas nos estados A e C.
A) TA = 0,5.TC
B) TA = 1,0.TC
C) TA = 1,5.TC
D) TA = 2,0.TC
E) TA = 2,5.TC
Equação geral dos gases perfeitos

À equação acima se dá o nome de lei geral dos gases perfeitos e você deve utiliza-la quando houver variação de pressão, volume e temperatura simultaneamente, mantendo-se constante a massa.
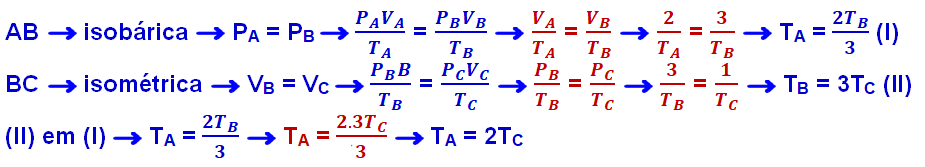
R- D
06- (Instituto Federal de Educação, Ciência e Tecnologia Fluminense – IFF – 2020)

Maria está fazendo uma experiência com um gás ideal.

O gás está confinado em um recipiente e, inicialmente, sua temperatura, pressão e volume são, respectivamente,![]() .
.
Ela então realiza dois processos com o gás.
Primeiro, ela o comprime até que seu volume e sua pressão tenham a metade do valor inicial.
No segundo processo, ela expande o gás até o volume inicial ![]() , mantendo a temperatura constante durante a expansão.
, mantendo a temperatura constante durante a expansão.
Depois desses processos, qual valor Maria encontrará ao medir a pressão do gás?
![]()

R- A
Princípios da Termodinâmica
07- (Faculdade de Ciências Médicas da Santa Casa de São Paulo – SP – 2020)

O diagrama P × V mostra as transformações isotérmica (AB), isovolumétrica (BC) e isobárica (CD) sofridas por certa massa de gás ideal.
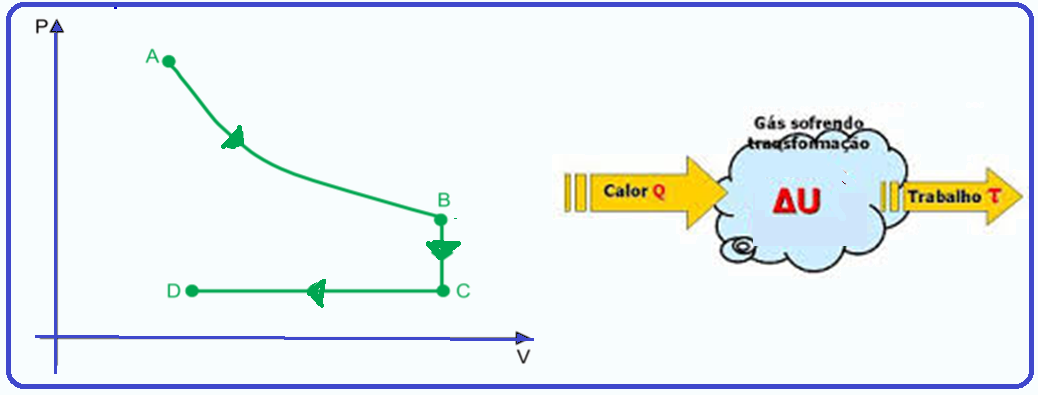
A energia interna do gás diminuiu
(A) apenas nas transformações AB e BC.
(B) apenas nas transformações BC e CD.
(C) apenas na transformação CD.
(D) apenas na transformação AB.
(E) em todas as transformações
Se você não domina a teoria, ela está a seguir:
Primeiro princípio da termodinâmica aplicado numa transformação Isotérmica
Primeiro princípio da termodinâmica aplicado numa transformação Isobárica
Primeiro princípio da termodinâmica aplicado numa transformação Isocórica, Isométrica ou Isovolumétrica

R- B
08- (UDESC – Universidade do Estado de Santa Catarina – 2020)

Considere a Figura abaixo que descreve os ciclos termodinâmicos ABCD e ACD.
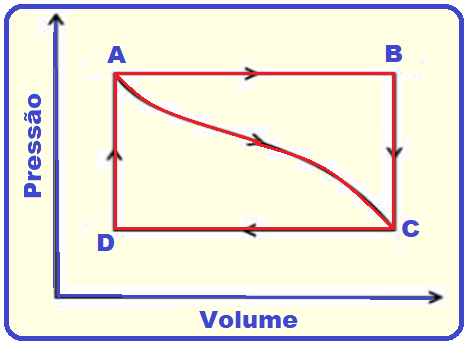
Analise as proposições em relação à Figura.
I. O trabalho realizado sobre o sistema para ir de A a D é igual a percorrer o ciclo pelos caminhos ABCD e ACD.
II. A variação da energia interna entre B e C e entre D e A é dada somente por troca de calor entre o sistema e o seu entorno.
III. Em qualquer ciclo fechado, conforme mostra a Figura 5, o calor total é igual ao trabalho total ao longo do ciclo.
IV. O ciclo ABCD é composto por duas transformações isobáricas e duas isocóricas.
V. O trabalho para ir de A a B pode ser calculado pela área delimitada por ABCD.
Assinale a alternativa correta.
A. ( ) Somente as afirmativas I, II e III são verdadeiras.
B. ( ) Somente as afirmativas I, III e V são verdadeiras.
C. ( ) Somente as afirmativas I, III e IV são verdadeiras.
D. ( ) Somente as afirmativas II, IV e V são verdadeiras.
E. ( ) Somente as afirmativas II, III e IV são verdadeiras.
I. Falsa
Principais características da transformação cíclica
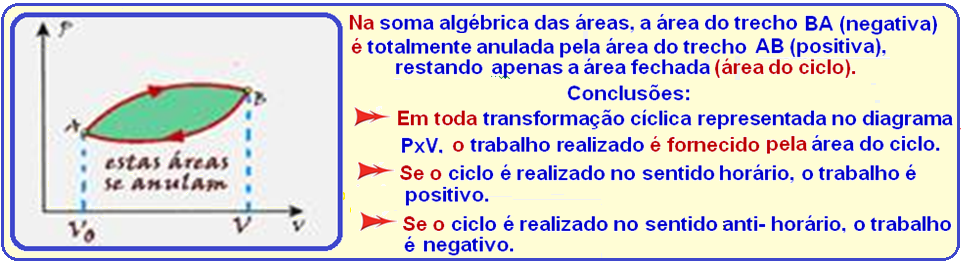
Veja que as áreas dos ciclos ABCDA (A1) e ACDA (A2) são diferentes e consequentemente o trabalho
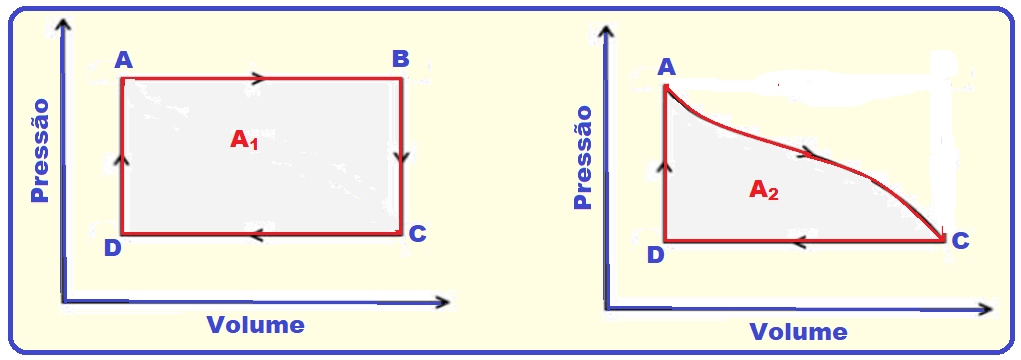
realizado em cada ciclo também é diferente.
II. Correta
Nesses dois trechos BC e DA a transformação é isovolumétrica (volume constante) cujas características estão a seguir.
Primeiro princípio da termodinâmica aplicado numa transformação Isocórica, Isométrica ou Isovolumétrica

III. Correta

IV. Correta
AB e CD ![]() isobáricas
isobáricas
BD e CA ![]() isocóricas (isométricas ou isovolumétricas)
isocóricas (isométricas ou isovolumétricas)
V. Falsa
É calculado pela área A da figura abaixo e não pela área do ciclo
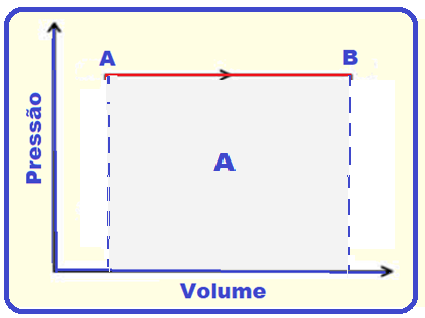
R- E
09- (Universidade Estadual do Oeste do Paraná – UNIOESTE – 2020)

O segundo princípio da Termodinâmica assegura que é impossível construir uma máquina térmica

operando em ciclos cujo único efeito seja retirar calor de uma fonte e convertê-lo integralmente em trabalho.
Considerando as consequências deste princípio é CORRETO afirmar que:
a) máquinas térmicas são dispositivos que convertem energia mecânica em energia térmica por meio da realização de trabalho e consumo de calor.
b) o rendimento de uma máquina térmica será de 100% quando o calor retirado da fonte em cada ciclo de operação da máquina for nulo.
c) o rendimento de uma máquina térmica nunca pode chegar a 100%, pois nenhuma máquina térmica consegue transformar integralmente calor em trabalho.
d) qualquer máquina térmica retira calor de uma fonte quente e rejeita integralmente esse calor para uma fonte fria após realizar um trabalho mecânico.
e) uma máquina térmica que realiza uma transformação cíclica retornando ao estado inicial, depois de efetuar todos os processos termodinâmicos do ciclo, tem rendimento de 100%.
Segundo Princípio da Termodinâmica
Pode-se definir o Segundo Princípio da Termodinâmica da seguinte maneira: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho”

É impossível transformar calor de uma fonte quente (Qq) em energia útil (trabalho W) sem que ocorra perdas para a fonte fria Qf).
Você pode reduzir essas perdas, por exemplo, diminuindo os atritos, mas nunca eliminá-las totalmente.
Se você conhecer o quanto de trabalho (W) a máquina térmica produz e o quanto de calor (Q) foi fornecido pela fonte quente, você pode calcular o rendimento (η) de uma máquina térmica.
Rendimento (η) de uma máquina térmica ![]() η =
η = ![]()
Observe na expressão acima que a eficiência (rendimento) da máquina térmica é sempre menor do que 1 (100%).
R- C
10- (Faculdade de Medicina de Jundiaí – FMJ –SP – 2020)

O diagrama pressão versus volume mostra a transformação cíclica ABCDA pela qual passa certa massa de gás ideal.
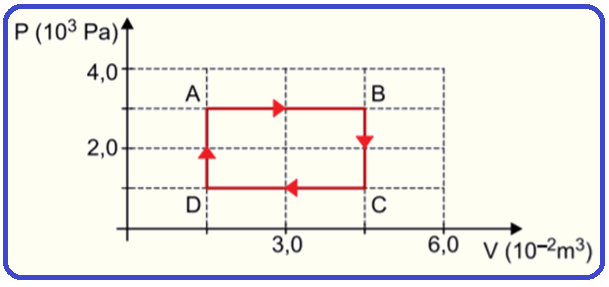
Em um ciclo, a variação da energia interna do gás é igual a
![]()
Transformação cíclica
Consiste numa série de transformações gasosas na qual o estado inicial coincide com o estado final, com o gás retornando à mesma pressão, volume e temperatura iniciais.
Toda transformação cíclica deve obedecer à seguinte condição:
Como as temperaturas final e inicial são coincidentes (Ti = Tf), a variação de energia interna (ΔU) é nula ![]() ΔU = 0.
ΔU = 0.
R- C
11- (CEDERJ – RJ – meio do ano – 019/029)

Uma amostra de gás ideal está contida em um cilindro metálico que está imerso em uma grande quantidade de água a temperatura constante. O gás é comprimido lentamente numa transformação isotérmica.
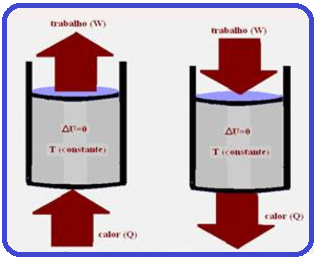
A variação da energia interna do gás (ΔU) e o trabalho W realizado pelo gás nesse processo são:
(A) ΔU = 0; W > 0
(B) ΔU = 0; W < 0
(C) ΔU > 0; W > 0
(D) ΔU < 0; W < 0
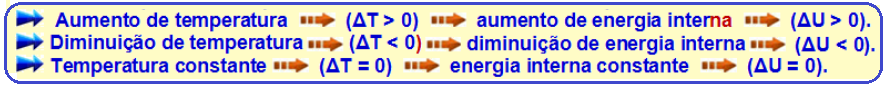
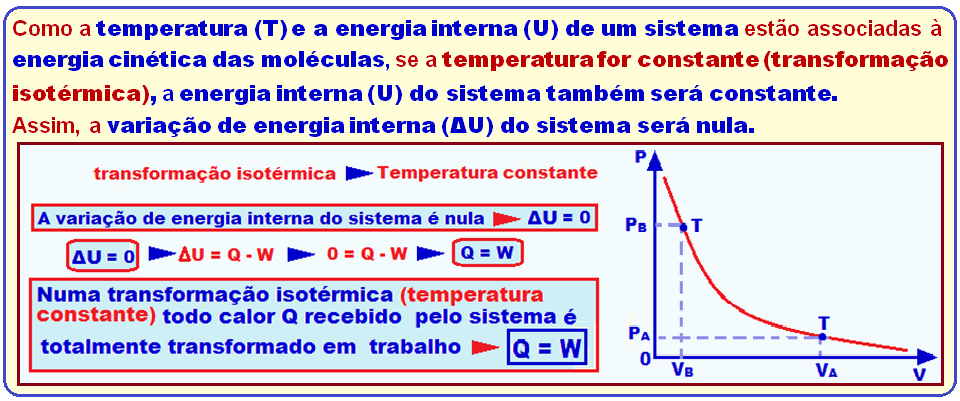
Transformação isotérmica
Como a temperatura (T) e a energia interna (U) de um sistema estão associadas à energia cinética das moléculas, se a temperatura for constante (transformação isotérmica), a energia interna (U) do sistema também será constante.
Assim, a variação de energia interna (ΔU) do sistema será nula.
Transformação isotérmica ![]() ΔU = 0
ΔU = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() 0 = Q – W
0 = Q – W ![]() Q = W.
Q = W.
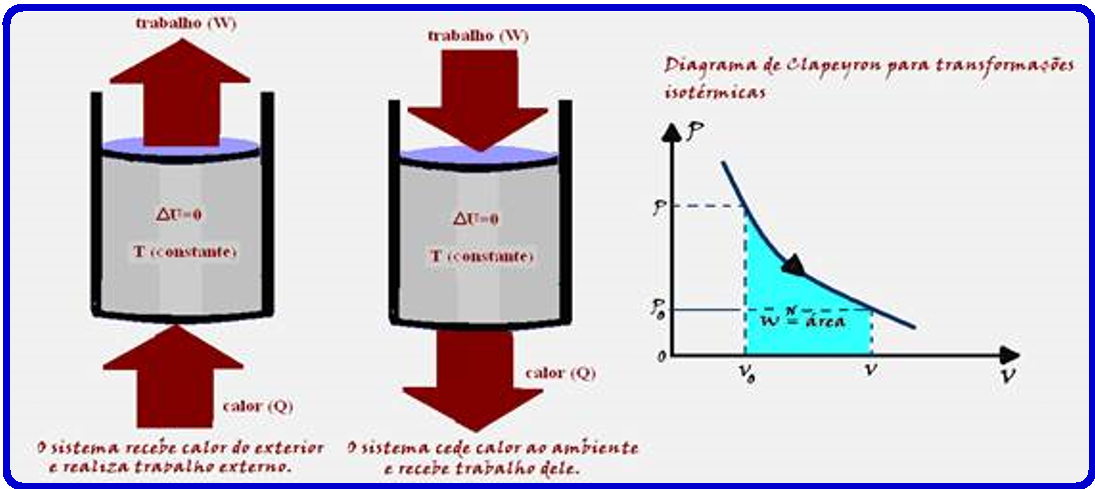
Q = W ![]() Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.
Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.

Como o gás é comprimido o trabalho realizado é negativo. (W < 0).
R- B
12- (CEDERJ-RJ-2020)

Considere um tubo vertical fechado na extremidade inferior que aprisiona um gás ideal em seu interior por meio de um leve êmbolo situado na extremidade oposta.
Lentamente, o êmbolo é pressionado até que o volume do gás se reduz à metade.
Considere duas formas de fazer isso.
No processo I, o tubo é mantido em contato térmico com um grande recipiente com água.
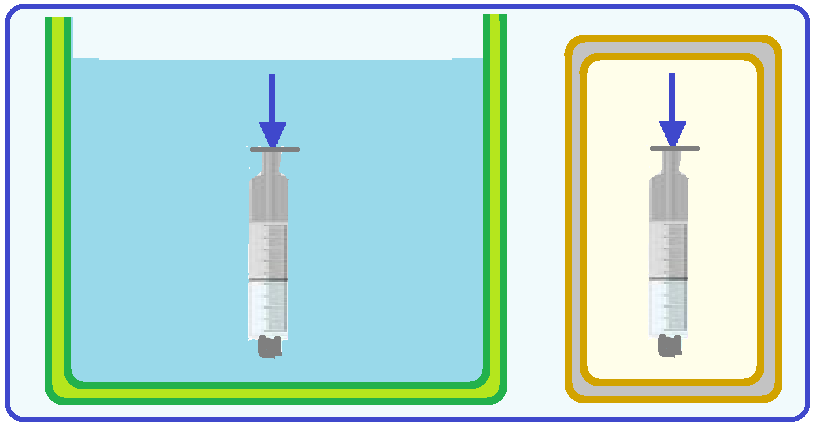
No processo II, o tubo é isolado termicamente do ambiente.
As descrições dos processos I e II e a avaliação das variações de energia interna correspondem a: (A) Processo I: compressão isotérmica; Processo II: compressão adiabática; A energia interna do gás aumenta nos dois processos.
(B) Processo I: compressão adiabática; Processo II: compressão isotérmica; A energia interna do gás aumenta nos dois processos.
(C) Processo I: compressão isotérmica; Processo II: compressão adiabática; A energia interna do gás aumenta somente no segundo processo.
(D) Processo I: compressão adiabática; Processo II: compressão isotérmica; A energia térmica do gás aumenta somente no segundo processo.
No processo I sendo grande a quantidade de água a temperatura do gás é a mesma que a da água (constante) e está sendo comprimido ![]() trata-se de uma compressão isotérmica (a temperatura constante).
trata-se de uma compressão isotérmica (a temperatura constante).
No processo II como ele é isolado termicamente ele não troca calor com o ambiente (transformação adiabática) e está sendo comprimido ![]() trata-se de uma compressão adiabática.
trata-se de uma compressão adiabática.
A energia interna do gás está relacionada com a variação da temperatura do mesmo e no primeiro processo, como a temperatura é constante a energia interna do gás permanece constante.
No segundo processo (transformação adiabática) a teoria está a seguir:
Transformação adiabática
Nela, o sistema não troca calor com o meio externo (Q = 0) e isso ocorre porque o gás está termicamente isolado ou porque a transformação é muito rápida de modo que qualquer troca de calor com possa ser considerada.
Se Q = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = 0 – W
ΔU = 0 – W ![]() ΔU = – W.
ΔU = – W.

Então, todo o trabalho realizado pelo pistão é transformado em energia interna.
R- C
13- (FDSBC-SP-2020)

Um motor a combustão, movido a etanol, cuja massa específica é de 0,789 g/cm³ e calor de combustão igual a 6 400 kcal/kg, consome 5 litros a cada 30 minutos de funcionamento em regime constante.

Nessa condição, ele desenvolve uma potência útil de 23 565 W.
Determine, em porcentagem, o rendimento aproximado desse motor. Adote 1 cal=4,2J.
A) 36
B) 38
C) 40
D) 42
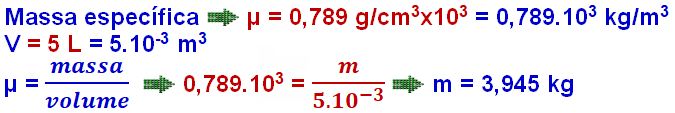
Regra de três


R- C
14- (EsPCEx – AMAN – SP – RJ – 2020)

Um gás ideal é comprimido por um agente externo, ao mesmo tempo em que recebe calor de 300 J de uma fonte térmica.
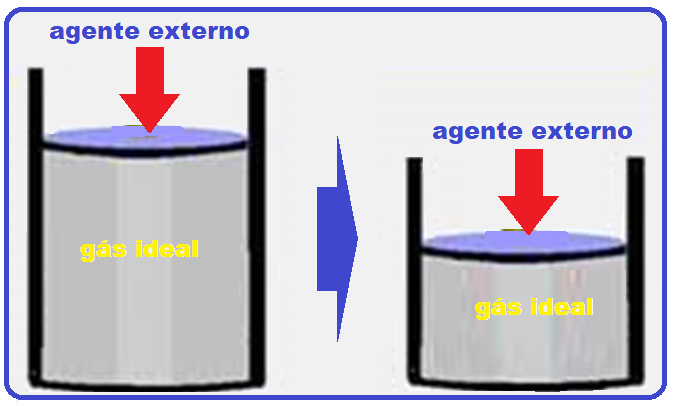
Sabendo-se que o trabalho do agente externo é de 600 J, então a variação de energia interna do gás é
![]()
Se você não domina a teoria, veja o resumo a seguir:
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
Energia interna de um gás perfeito
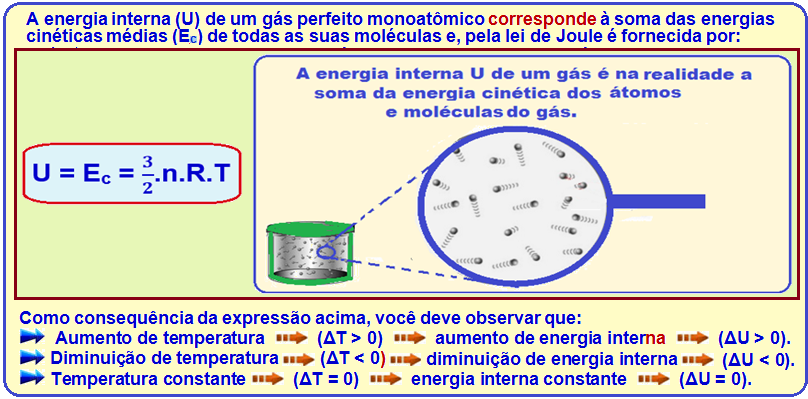
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
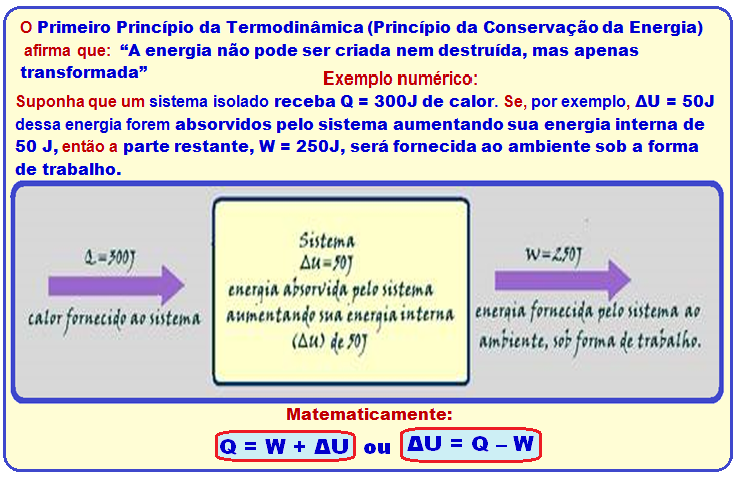
Trabalho positivo ou trabalho negativo
Na expressão W = P.(V – Vo), como a pressão P é sempre positiva:
![]() Se V > Vo
Se V > Vo ![]() W > 0
W > 0 ![]() o sistema (gás) em expansão realiza trabalho sobre o meio exterior (ambiente).
o sistema (gás) em expansão realiza trabalho sobre o meio exterior (ambiente).
![]() Se V < Vo
Se V < Vo ![]() W < 0
W < 0 ![]() o meio exterior (ambiente) realiza trabalho sobre o sistema (gás).
o meio exterior (ambiente) realiza trabalho sobre o sistema (gás).
Como o gás recebe calor da fonte térmica ![]() Q = + 300 J
Q = + 300 J
Se o gás ideal é comprimido por um agente externo (volume final menor que volume inicial) o trabalho é negativo e o meio exterior (ambiente) realiza trabalho sobre o sistema (gás) ![]() W = – 600 J.
W = – 600 J.
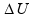 = Q – W = 300 – (-600) = 300 + 600
= Q – W = 300 – (-600) = 300 + 600 ![]()
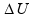 = 900 J.
= 900 J.
R- A
15- (FUVEST- SP- 2020 – Segunda Fase)



a)
Transformação adiabática



Exemplo prático
Na figura abaixo, trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio
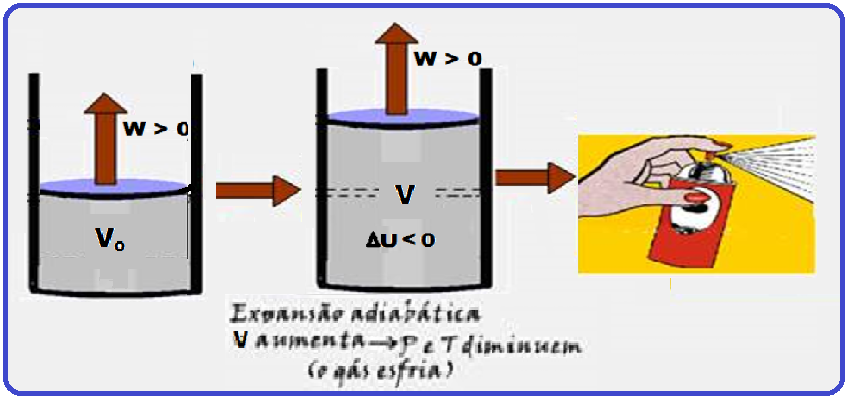

b)

16- (Instituto Federal de Educação, Ciência e Tecnologia Fluminense – IFF – 2020)

A figura a seguir representa o ciclo de um motor a combustão patenteado por Rudolf Diesel.
Ele é composto por dois processos adiabáticos, um isovolumétrico e um isobárico.
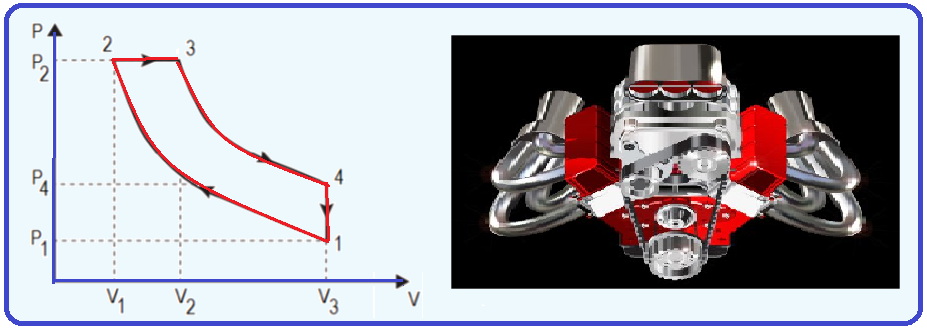
Qual é a eficiência de um motor construído com esse ciclo em que o módulo do calor trocado no processo isobárico é de 800 J e o módulo do calor trocado no processo isovolumétrico é de 300 J?
![]()
Rendimento de uma máquina térmica de Carnot


R – D
17- (Instituto Militar de Engenharia – IME – 2020)

Um escritório de patentes analisa as afirmativas de um inventor que deseja obter os direitos sobre três máquinas térmicas reais que trabalham em um ciclo termodinâmico. Os dados sobre o calor rejeitado para a fonte fria e o trabalho produzido pela máquina térmica – ambos expressos em Joules – encontram-se na tabela abaixo.

As afirmativas do inventor são:
Afirmativa 1: O rendimento das máquinas A e C são os mesmos para quaisquer temperaturas de fonte quente e de fonte fria.
Afirmativa 2: As máquinas A, B e C obedecem à Segunda Lei da Termodinâmica.
Afirmativa 3: Se o calor rejeitado nas três situações acima for dobrado e se for mantida a mesma produção de trabalho, a máquina B apresentará rendimento superior aos das máquinas A e C, supondo atendidos os princípios da termodinâmica.
Tomando sempre as temperaturas dos reservatórios das fontes quente e fria das máquinas como 900 K e 300 K, está(ão) correta(s) a(s) afirmativa(s):
-
(A) 1, apenas.
-
(B) 2, apenas.
-
(C) 1, 2 e 3.
-
(D) 1 e 3, apenas.
-
(E) 2 e 3, apenas.
Começando pela afirmativa 1, precisamos nos lembrar de como se calcula o rendimento de uma máquina térmica:

Não se esqueça que o calor da fonte quente é a soma do trabalho produzido com o calor da fonte fria (calor rejeitado).
Por definição, e como podemos visualizar nas fórmulas, o rendimento da máquina térmica real não irá depender das temperaturas. Portanto, para todas as temperaturas o rendimento será o mesmo, o qual já foi calculado para a máquina A e C. Afirmativa 1 é verdadeira.
Para a afirmativa 2 vamos nos lembrar o que a Segunda Lei da Termodinâmica nos diz:

Ou seja, não importa a máquina térmica, o seu rendimento nunca será 100%. Em seus estudos Carnot enunciou que nenhuma máquina térmica real poderia ter eficiência maior ou igual ao do Ciclo de Carnot, para assim não violar a segunda lei. Vamos calcular a eficiência desse ciclo ideal:

O rendimento da máquina B ainda será maior que todas as outras, portanto a afirmativa 3 está correta.
Após analisar todas as afirmativas concluímos que a alternativa correta é a D.
18- (MACKENZIE – SP – 2020)

A segunda lei da Termodinâmica afirma, em sucintas palavras, que não há a possibilidade de converter integralmente calor em trabalho.
Esquematicamente, a figura abaixo revela como funciona uma máquina térmica.
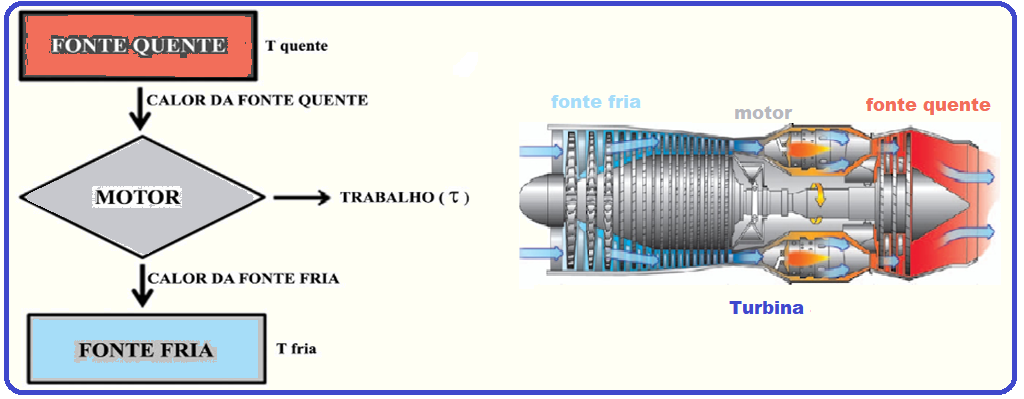
Considerando-se que o trabalho realizado nessa máquina valha 1,2 kJ e que a parte energética rejeitada para a fonte fria valha dois quintos da recebida da fonte quente, é correto afirmar que o rendimento da máquina retratada na figura e a parte energética rejeitada (em kJ) valem, respectivamente,
a) 40% e 1,2
b) 60% e 0,80
c) 40% e 1,0
d) 60% e 1,2
e) 40% e 0,60
Rendimento de uma máquina térmica de Carnot

 R- B
R- B
19- (PUC – Rio – 2020)

Considere as três afirmativas abaixo, em relação a um gás ideal.
I – Em uma compressão adiabática, a temperatura final do gás não pode ser maior do que a inicial, pois nenhum calor é trocado com a vizinhança.
II – Em um processo isocórico (isovolumétrico), nenhum trabalho é realizado pelo gás.
III – Em um processo isobárico, o trabalho realizado pelo gás é proporcional ao quadrado da variação do volume.
Marque a única opção CORRETA:
(A) Somente a afirmativa I é verdadeira.
(B) Somente a afirmativa II é verdadeira.
(C) Somente a afirmativa III é verdadeira.
(D) Somente as afirmativas I e II são verdadeiras.
(E) Somente as afirmativas I e III são verdadeiras.
I. Falsa

Leia atentamente as informações a seguir as aplicações práticas de algumas transformações adiabáticas:
Na figura da esquerda abaixo, ao levantar o pistão da bomba de bicicleta, você diminui a pressão interna o que faz abrir uma válvula localizada abaixo do pistão, fazendo o ar externo penetrar no cilindro.
Ao empurrar o pistão para baixo o aumento de pressão interna fecha automaticamente a válvula de entrada e abre a válvula de saída ligada ao pneu forçando o ar a penetrar no mesmo. Ao levantar o pistão novamente você começa tudo novamente.
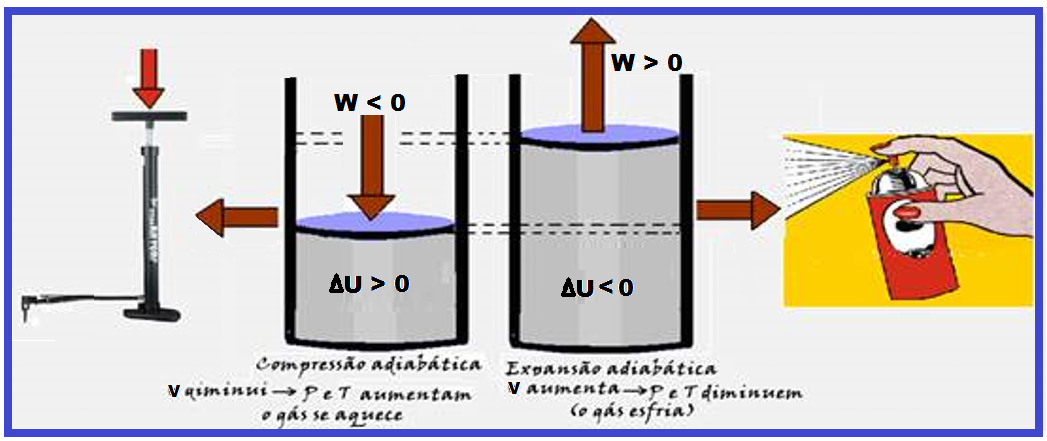
Observe que, cada vez que você bombeia o ar no pneu, a bomba se aquece mais, o que ocorre principalmente porque você está forçando as moléculas de ar ficar mais próximas umas das outras, fazendo com que esse trabalho de compressão do gás (negativo) aumente a energia interna (ΔU), aumentando consequentemente a temperatura do gás.
Isso ocorre porque essa transformação é adiabática (não troca calor com o ambiente, pois é muito rápida) e obedece à função ΔU= – W.
Na figura da direita (acima), trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio ambiente), onde Q = 0 e ΔU = Q – W ![]() ΔU = 0 – W
ΔU = 0 – W ![]() ΔU = – W
ΔU = – W ![]() o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão, e o gás resfria.
o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão, e o gás resfria.
Leia atentamente as informações da figura da esquerda acima (compressão) adiabática que, apesar de o gás não trocar calor com o ambiente após a compressão a temperatura do gás aumenta.
II. Correta
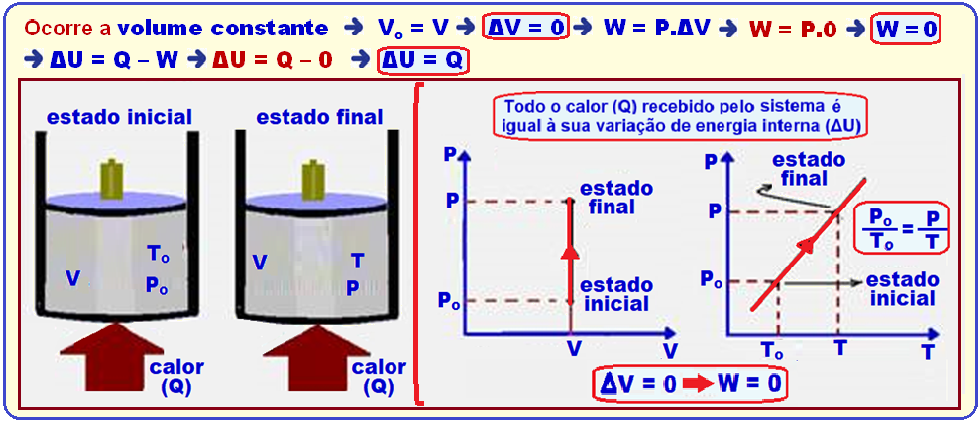
Transformação isocórica, isométrica ou isovolumétrica
Ocorre a volume constante ![]() Vo = V
Vo = V ![]() ΔV = 0
ΔV = 0 ![]() W = P.ΔV
W = P.ΔV ![]() W = P.0
W = P.0 ![]() W = 0
W = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = Q – 0
ΔU = Q – 0 ![]() ΔU = Q
ΔU = Q

III. Falsa
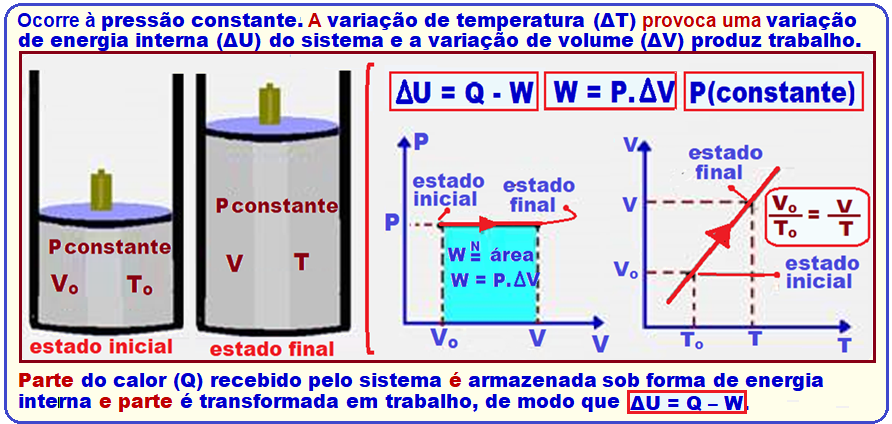
Transformação isobárica
Ocorre à pressão constante. A variação de temperatura (ΔT) provoca uma variação de energia interna (ΔU) do sistema e a variação de volume (ΔV) produz trabalho.
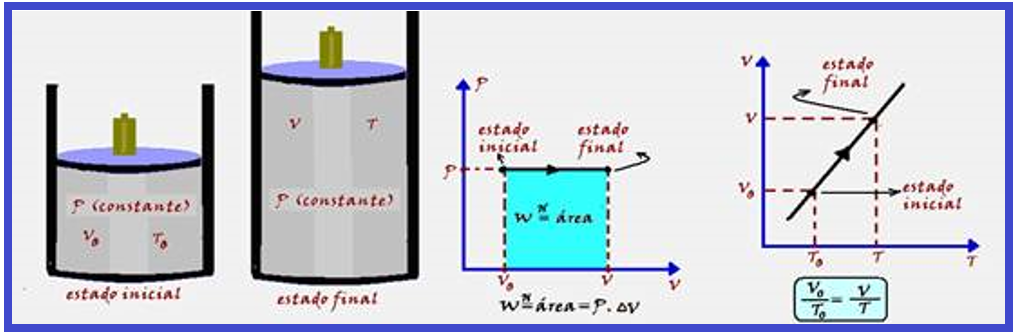
Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W.

R- B


