Resolução Comentada – Termodinâmica – 2018-2019
Resolução Comentada – Termodinâmica – 2018-2019
01-
Equação geral dos gases perfeitos

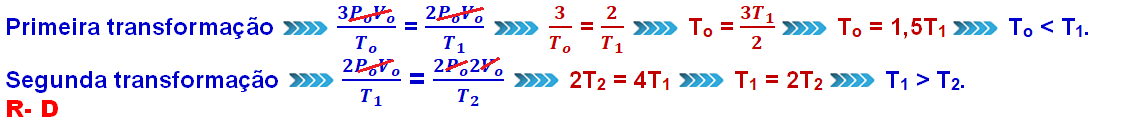
02-

(F) Pelo gráfico o material Y se contrai (volume diminui) quando a temperatura aumenta até 5 oC, e
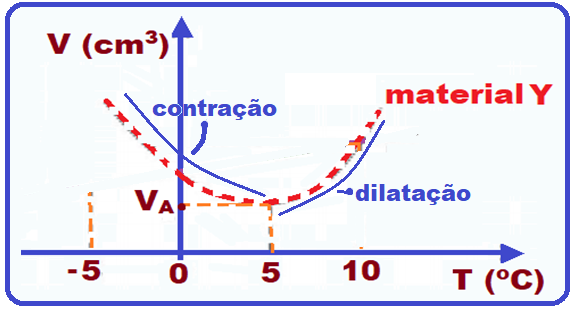
somente a partir dessa temperatura passa a dilatar-se (volume aumentando).
(V) Veja no gráfico que em T = 5 oC o volume de Y (VY) é menor que o de X (VX).

R- A
03-

04-
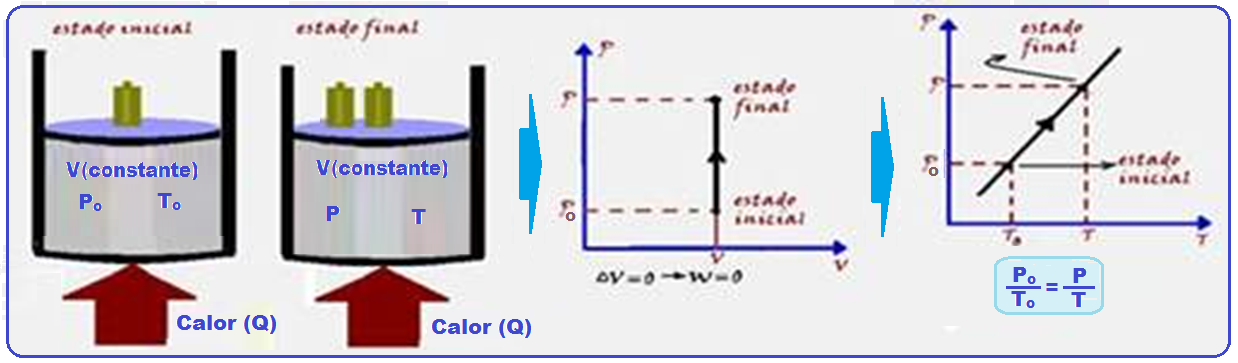
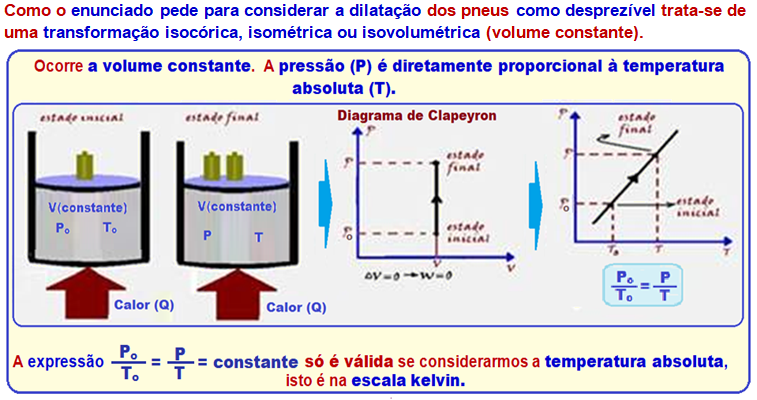
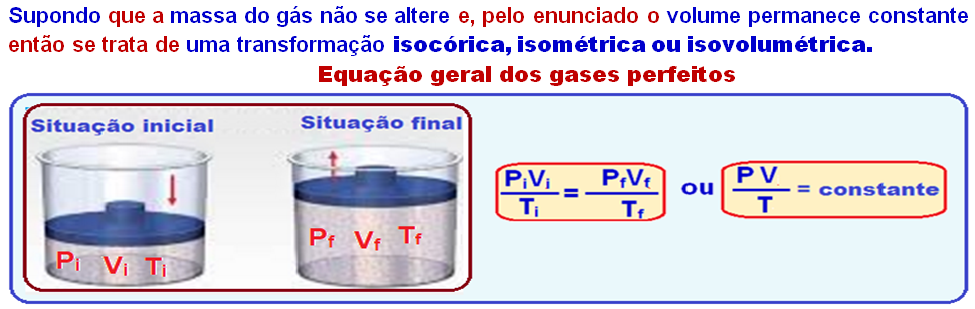
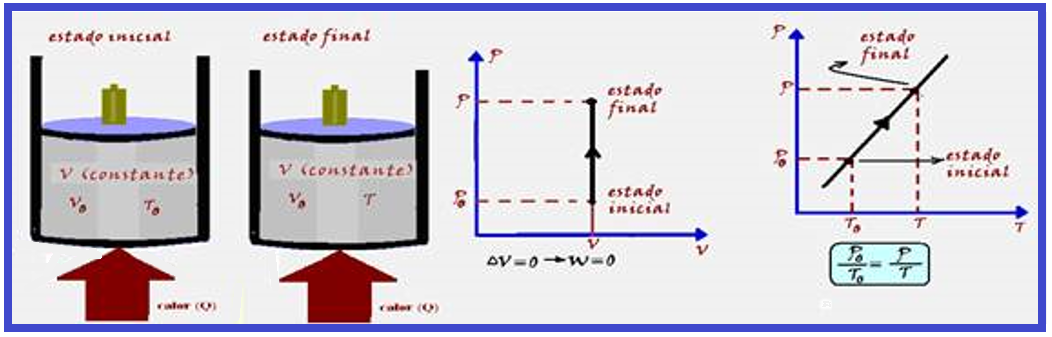
Transformação isocórica, isométrica ou isovolumétrica
Nessa transformação o volume é mantido constante (isso=igual; coros=volume).
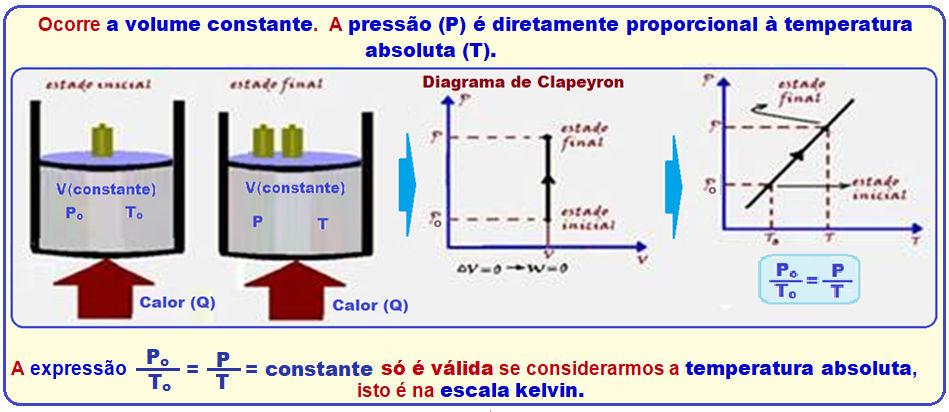
Os físicos Jacques Charles e Gay-Lussac descobriram experimentalmente que, numa transformação isocórica, a pressão (P) é diretamente proporcional à temperatura absoluta (T), ou seja:
A expressão acima só é válida se considerarmos a temperatura absoluta, isto é, na escala kelvin.
Se a temperatura for medida em graus Celsius, isso não se aplica.
Na expressão Po /To = P/T, conhecida como lei de Charles, Po e To representam a pressão e a temperatura absoluta do gás no estado inicial: P e T representam, respectivamente, a pressão e a temperatura absoluta do gás no estado final.
![]()
Pode-se transformar uma indicação de uma escala para outra conforme o procedimento a seguir,

de acordo com a relação matemática baseada no teorema de Thales.
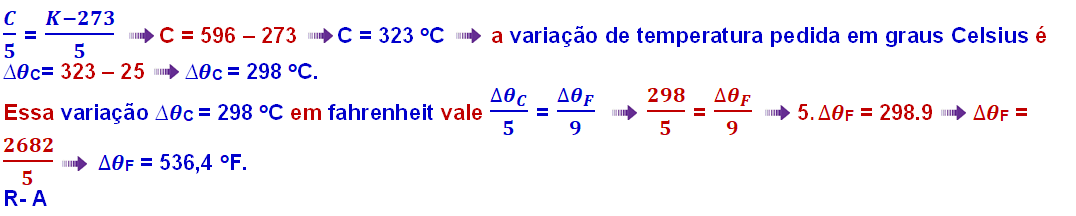
05-
Transformação isobárica
Ocorre à pressão constante (isso = igual; barros = pressão).
O físico Jacques Charles observou que, para certa massa de gás perfeito, mantida a pressão constante, o volume é diretamente proporcional à temperatura absoluta, ou seja:
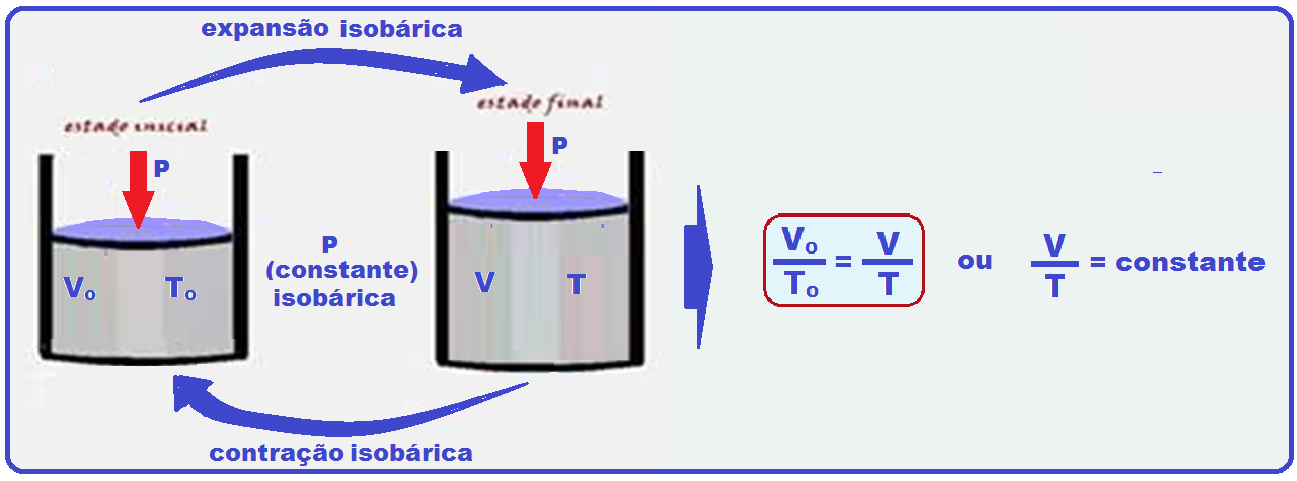
A relação acima é denominada lei de Charles e Gay-Lussac para transformações isobáricas e cujo gráfico V x T está representado abaixo:
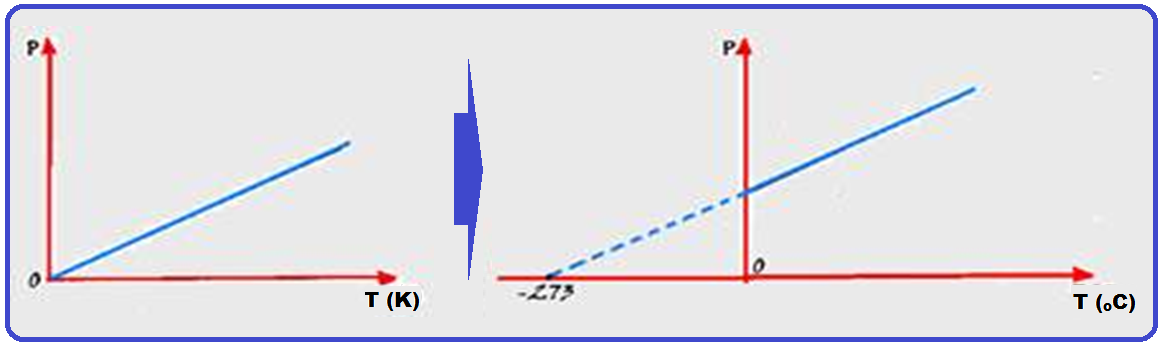

R- C
06-
Sublimação é um fenômeno físico-químico que consiste na passagem direta de uma substância do estado sólido para o estado gasoso e vice-versa, sem passar pelo estado líquido.
Alguns dos exemplos mais comuns de sublimação são a naftalina, iodo e gelo seco.
R- B
07-
Transformação isobárica

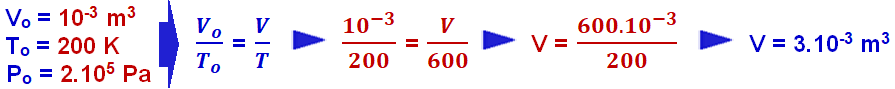
Transformação isotérmica


R- A
08-
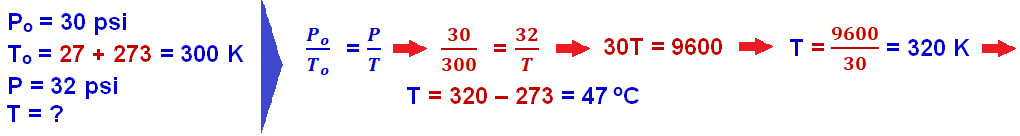 R- C
R- C
09-

R- E
10-
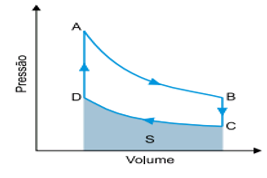
Podemos calcular a eficiência η da máquina como a razão entre o trabalho W realizado pela máquina e o calor Q inserido nela:
 O trabalho realizado se obtém através da área compreendida dentro do ciclo triangular, logo, obtemos o trabalho como
O trabalho realizado se obtém através da área compreendida dentro do ciclo triangular, logo, obtemos o trabalho como
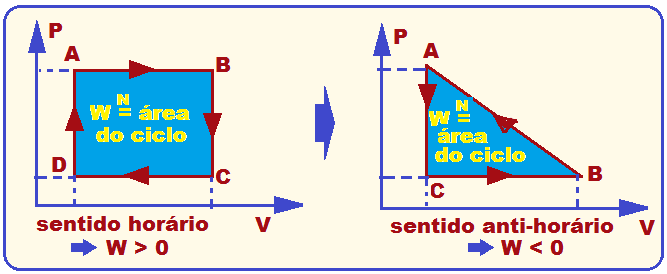
Já o calor inserido deve ser calculado sobre as trajetórias de A a B e de B a C, pois é onde a temperatura aumenta. Como o gás é ideal e monoatômico, convém relembrar algumas relações para esse tipo de gás utilizando o número de mols n e a constante dos gases ideais R:

11-
A válvula de segurança só será acionada se a temperatura do gás atingir um valor limite T e, até que isso ocorra o volume do gás no interior da panela será constante (transformação isocórica, isométrica ou isovolumétrica).
Transformação isocórica, isométrica ou isovolumétrica

12-

R- A
13-
Diagrama de estado – ponto triplo, tríplice – C)
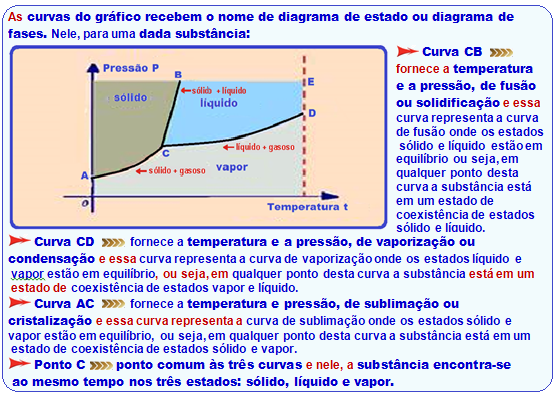
Veja figura abaixo:
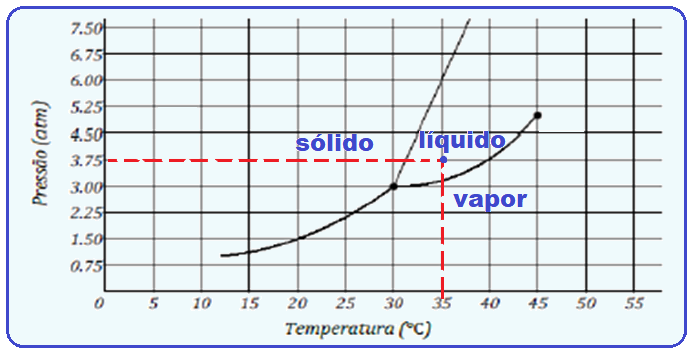
R- A
14-
Transformação isotérmica
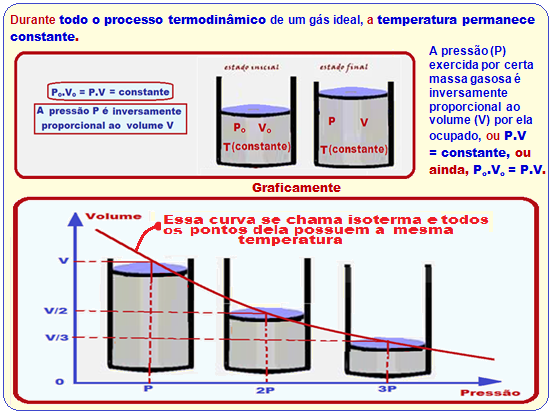
Po.Vo = P.V ![]() Po.Vo = P.Vo/2
Po.Vo = P.Vo/2 ![]() Po/P = 1/2
Po/P = 1/2
R- E
15-
Primeiro princípio da termodinâmica aplicado numa transformação Cíclica
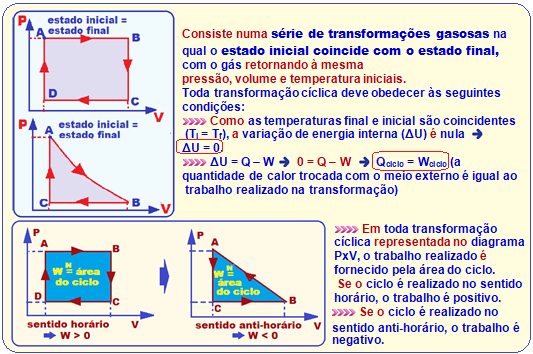
A alternativa correta é a (A) conforme as informações acima.
R- A
16-
Rendimento de uma máquina térmica de Carnot:

η = 1 – = 1 – = 1 – 0,2 η = 0,8 η = 80%.
R- D
17-
(A) Falsa ► não são equivalentes apesar de serem isotérmica, pois ocorrem a temperaturas diferentes e, em AB recebe energia do meio exterior e em CD cede energia ao meio exterior.
(B) Correta ► a temperatura está aumentando e quando isso acontece a energia interna do sistema aumenta.
(C) Falsa ►o trabalho realizado corresponde à área do ciclo.
(D) Falsa ► são duas isotérmicas e duas isovolumétricas (isocóricas ou isométricas).
(E) Falsa ► a temperatura é constante, mas o volume está aumentando e o gás está recebendo calor.
R- B
18-
Quando dois ou mais corpos que estão a temperaturas diferentes são colocados em contato, ocorrerá uma transferência de energia do corpo de maior temperatura para o corpo de menor temperatura.
Essa transferência de energia ocorre até que os dois corpos tenham a mesma temperatura (mesmo
estado térmico, mesmo nível de vibração das moléculas), estejam numa situação de equilíbrio.
Essa transferência de energia recebe o nome de calor.
Então o gás que está na primeira câmara (menor temperatura) recebe calor da outra de maior
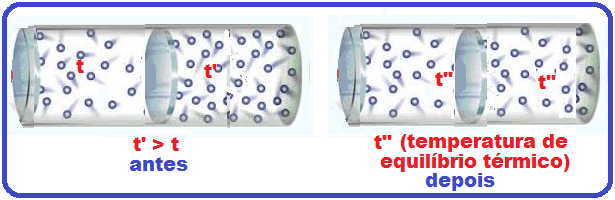
temperatura (Q > 0) e sua energia interna aumenta porque sua variação de temperatura também aumenta (ΔU > 0).
R- A
19-
Segundo Princípio da Termodinâmica

R- B
20-
Veja o formulário abaixo

R- D
21-
Rendimento de uma máquina térmica de Carnot


R- B
22-
a) Por tratar-se de um gás ideal, podemos utilizar a lei de Clapeyron:
![]()
Onde P, V, T e n são, respectivamente, pressão, volume, temperatura e número de mols do gás. R é a constante universal dos gases. Do enunciado e da figura, temos que AB e CD são transformações isotérmicas, DA e BC transformações volumétricas.
Nos pontos B e C os volumes são constantes, fazendo com que a equação de Clapeyron se torne:

Aplicando a relação T/P nos pontos B e C:
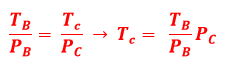
Substituindo os valores do enunciado, transformando a temperatura da isotérmica AB de Celsius para Kelvin e sabendo que a curva CD é isotérmica (mesma temperatura):

b) A primeira lei da termodinâmica é dada por:
![]()
Sendo Q a energia fornecida para o gás, W o trabalho exercido pelo gás e a energia interna armazenada pelo gás. Como a curva é isotérmica, deve ser nulo, visto que:
![]()
O trabalho W é dado pela área abaixo da curva no diagrama PxV dada no enunciado, logo, a energia interna é:
![]()
R- D
23-
a)
Fórmulas do rendimento de uma máquina térmica de Carnot

Quantidade de calor recebido pela fonte fria (condensador) ![]() Q1 = 1,2.109 J.
Q1 = 1,2.109 J.
Quantidade de calor fornecido pela fonte quente (caldeira) ![]() Q = 1,6.109 J.
Q = 1,6.109 J.

24-

25-
(V) Veja informação abaixo:
Transformação isocórica, isométrica ou isovolumétrica
Ocorre a volume constante ![]() Vo = V
Vo = V ![]() ΔV = 0
ΔV = 0 ![]() W = P.ΔV
W = P.ΔV ![]() W = P.0
W = P.0 ![]() W = 0
W = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = Q – 0
ΔU = Q – 0 ![]() ΔU = Q
ΔU = Q

(F) A energia interna (∆U) do gás é igual ao trabalho (W) realizado, com sinal invertido.
Veja informação abaixo:
Transformação adiabática
Nela, o sistema não troca calor com o meio externo (Q = 0) e isso ocorre porque o gás está termicamente isolado ou porque a transformação é muito rápida de modo que qualquer troca de calor com possa ser considerada.
Se Q = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() ΔU = 0 – W
ΔU = 0 – W ![]() ΔU = – W.
ΔU = – W.

(F) Há trocas de calor, que é distribuído conforme as informações abaixo:
Transformação isobárica
Ocorre à pressão constante. A variação de temperatura (ΔT) provoca uma variação de energia interna (ΔU) do sistema e a variação de volume (ΔV) produz trabalho.
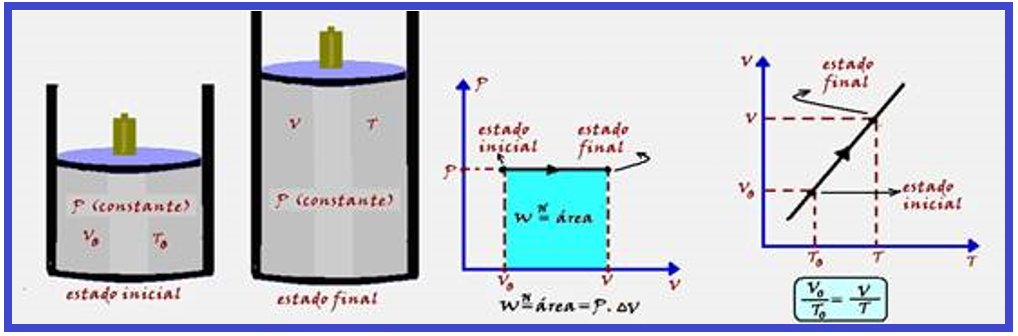
Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W.

(F) Isotérmica ocorre à temperatura constante.
Veja informação abaixo:
Transformação isotérmica
Como a temperatura (T) e a energia interna (U) de um sistema estão associadas à energia cinética das moléculas, se a temperatura for constante (transformação isotérmica), a energia interna (U) do sistema também será constante.
Assim, a variação de energia interna (ΔU) do sistema será nula.
Transformação isotérmica ![]() ΔU = 0
ΔU = 0 ![]() ΔU = Q – W
ΔU = Q – W ![]() 0 = Q – W
0 = Q – W ![]() Q = W.
Q = W.
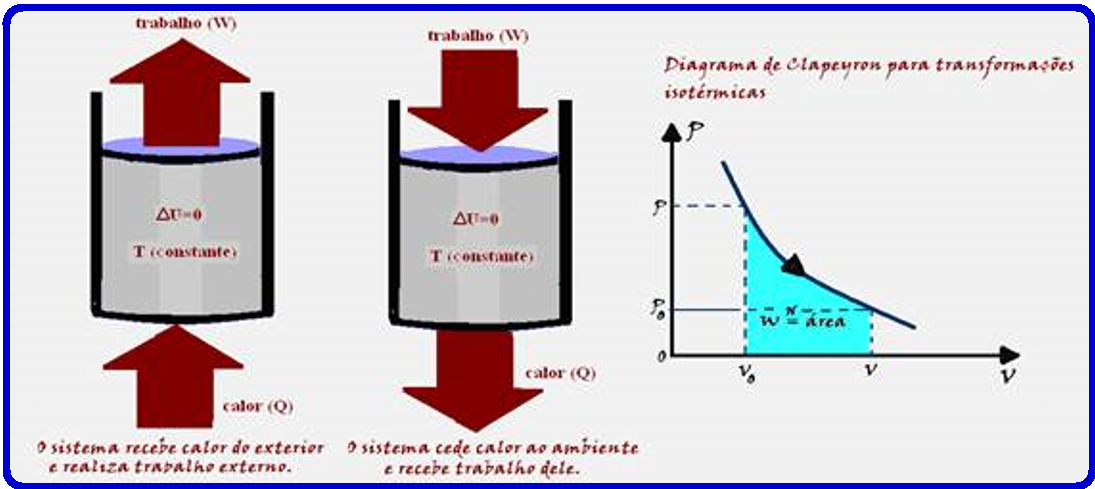
Q = W ![]() Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.
Portanto, numa transformação isotérmica (temperatura constante) todo calor Q recebido pelo sistema é totalmente transformado em trabalho.
R- E
26-

27-

